СТРОЕНИЕ АТОМА. ПЕРИОДИЧЕСКАЯ СИСТЕМА химических ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА
Периодичность свойств элементов и
Их соединений.
Между положением элемента в периодической системе и строением атома этого элемента существует взаимно-однозначное соответствие, т.е. координаты элемента в периодической системе определяют строение атома и наоборот, по строению атома можно определить его положение в периодической системе.
Для каждого элемента в периодической системе существует пять характеристик: порядковый номер Z, атомная масса А, номер периода, номер группы и подгруппа (главная или побочная). С точки зрения строения атома порядковый номер показывает число протонов в ядре. Атомная масса даёт сумму масс всех частиц атома: протонов, нейтронов и электронов. Учитывая, что масса электрона мала по сравнению с массой протона и нейтрона округлённо можно определять атомную массу, как сумму масс протонов и нейтронов. Отсюда легко найти число нейтронов в ядре как разность атомной массы и числа протонов: А – Z.Атом электронейтрален, поэтому число электронов в электронной оболочке равно числу протонов в ядре, т.е. порядковому номеру элемента –Z.
Номер периода показывает число энергетических электронных уровней в атоме.
Номер группы показывает общее число «валентных» электронов, т.е. электронов, которые могут принимать участие в образовании химических связей. Положение элемента в подгруппе (главной или побочной) определяется распределением «валентных» электронов: если элемент расположен в главной подгруппе, то все его валентные электроны находятся на последнем энергетическом электронном уровне, а все предыдущие уровни заполнены. Если элемент расположен в побочной подгруппе, то все остальные валентные электроны находятся на предпоследнем энергетическом уровне.
Существует форма записи энергетических состояний электронов в атоме, которая называется электронной формулой. В ней главное квантовое число обозначается цифрой (1, 2, 3, 4…), орбитальное –буквой(s-, p-, d-, f-),а число электронов на каждом подуровне показывается индексом вверху, например, электронная формула атома азота 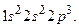 Фактически электронная формула есть распределение электронов по двум квантовым числам. Если же требуется дать распределение электронов по четырём квантовым числам, используют запись по энергетическим ячейкам или атомным орбиталям. Атомной орбиталью называется совокупность энергетических состояний электронов, характеризующихся определённым набором трёх квантовых чисел: главного, орбитального и магнитного
Фактически электронная формула есть распределение электронов по двум квантовым числам. Если же требуется дать распределение электронов по четырём квантовым числам, используют запись по энергетическим ячейкам или атомным орбиталям. Атомной орбиталью называется совокупность энергетических состояний электронов, характеризующихся определённым набором трёх квантовых чисел: главного, орбитального и магнитного  . Например, для атома азота электронно-графическая формула имеет вид:
. Например, для атома азота электронно-графическая формула имеет вид:
| ↓↑ | ↓ | ↓ | ↓ | |||||||||||||||
| ↓↑ | 2s | 2p |
1s
Основным или нормальным состоянием атома называется состояние, отвечающее минимальному запасу энергии, т.е. электроны занимают энергетические состояния с меньшей энергией. С небольшой затратой энергии (например, при воздействии светового излучения) электроны могут переходить в пределах одного энергетического уровня на более высокий энергетический подуровень. Атом переходит в «возбуждённое» состояние, например, для атома бериллия:
| Основное состояние | Возбуждённое состояние | ||||||||||||||
| 1s2 2s2 | ↓↑ | 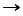 | 1s2 2s1 2p1 | ↓ | ↓ | ||||||||||
| ↓↑ | 2s | 2p | ↓↑ | 2s | 2p | ||||||||||
| 1s | 1s | ||||||||||||||
Строение внешних электронных уровней определяет формы и свойства его соединений. Например, для атома № 22 Ti имеем электронную формулу 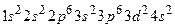 ,это d – элемент.
,это d – элемент.
Ti имеет всего четыре валентных электрона, поэтому высшая степень окисления +4.
Оксид, отвечающий этой степени окисления – TiO2, имеет амфотерный характер (с преобладанием основных свойств), поэтому соответствующий ему гидроксид может быть записан в двух формах: Ti(OH)4 или H2TiO3, соответственно он образует соли при взаимодействии и с кислотами и со щелочами:
Ti(OH)4 + 2Н2SO4 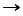 Ti (SO4)2 + 4H2O и H2TiO3 + 2NaOH
Ti (SO4)2 + 4H2O и H2TiO3 + 2NaOH 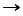 Na2TiO3 + 2H2O
Na2TiO3 + 2H2O
Ti(OH)4 + 2НCl 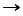 Ti Сl2 + 4H2O и H2TiO3 + K2O
Ti Сl2 + 4H2O и H2TiO3 + K2O 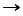 K2TiO3 + H2O
K2TiO3 + H2O
Низшая степень окисления Ti (как у большинства d–элементов) +2. Оксид TiО имеет основный характер, гидроксид Ti(OH)2 образует соли только с кислотами, например, TiSO4 или TiCl2.
Для характеристики любого элемента необходимо выполнить следующие действия:
1. Определить состав атома, т.е. указать число протонов, нейтронов и электронов.
2. Дать электронную формулу атома и распределение электронов внешних энергетических уровней по атомным орбиталям.
3. Определить высшую и низшую степень окисления и привести формулы и названия соединений, отвечающих данным степеням окисления.
Например, элемент № 34 Se.
Состав атома: (34 p, 46 n) 34 e.
Электронная формула: 1s22s22р63s23p63d104s24p4 – это p–элемент.
Электронно-графическая формула:
| ↓↑ | ↓ | ↓ | ↓↑ | |||||||||||||||
| ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | 4s | 4p | ||||||||
| 3s | 3p | 3d | ||||||||||||||||
Высшая степень окисления +6, оксид селена (VI) SeO3 – кислотный, гидроксид H2SeO4 - селеновая кислота, соли: Na2SeO4 - cеленат натрия, K2SeO4 - селенат калия.
Низшая степень окисления -2, H2S - селеноводород, K2Se - селенид калия, Na2Se - селенид натрия.
Свойства элементов, определяемые строением внешних электронных слоев атомов, закономерно изменяются по периодам и группам периодической системы. При этом сходство электронных структур порождает сходство свойств элементов–аналогов, но не тождественность этих свойств. Поэтому при переходе от одного элемента к другому в группах и подгруппах наблюдается не простое повторение свойств, а их более или менее ярко выраженное закономерное изменение. В частности, химическое поведение атомов элементов проявляется в их способности терять и приобретать электроны, т.е. в их способности к окислению и восстановлению. Количественной мерой способности атома терять электроны является потенциал ионизации(Еи), а мерой способности их приобретать – сродство к электрону (Ес). Характер изменения этих величин при переходе от одного периода к другому повторяется, причем в основе этих изменений лежит изменение электронной конфигурации атома. Так, завершенные электронные слои, соответствующие атомам инертных газов, обнаруживают повышенную устойчивость и повышенное значение потенциалов ионизации в пределах периода. В то же время наименьшими значениями потенциала ионизации обладают s–элементы первой группы (Li, Na, K, Rb, Cs).
Электроотрицательность является мерой способности атома данного элемента оттягивать на себя электроны по сравнению с атомами других элементов в соединении. Согласно одному из определений (Малликен), электроотрицательность атома 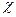 может быть выражена как полусумма его энергии ионизации и сродства к электрону:
может быть выражена как полусумма его энергии ионизации и сродства к электрону: 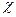 =
= 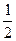 (Еи + Ес).
(Еи + Ес).
В периодах наблюдается общая тенденция роста электроотрицательности элемента, а в подгруппах – ее снижение. Наименьшими значениями электроотрицательности обладают s–элементы I группы, а наибольшими – р–элементы VII группы.
Электроотрицательность одного и того же элемента может меняться в зависимости от валентного состояния, гибридизации, степени окисления и пр. Электроотрицательность существенно влияет на характер изменения свойств соединений элементов. Так, например, серная кислота проявляет более сильные кислотные свойства, чем ее химический аналог – селеновая кислота, поскольку в последней центральный атом селена из-за меньшей по сравнению с атомом серы электроотрицательности не так сильно поляризует связи Н–О в кислоте, что и означает ослабление кислотности.
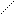
 Н–О O
Н–О O


 Se
Se
Н–О O
Другой пример: гидроксид хрома (II) и гидроксид хрома (VI). Гидроксид хрома (II), Cr(OH)2, проявляет основные свойства в отличие от гидроксида хрома (VI), Н2CrO4, поскольку степень окисления хрома +2 обусловливает слабость кулоновского взаимодействия Cr2+ с гидроксид-ионом и легкость отщепления этого иона, т.е. проявление основных свойств. В то же время высокая степень окисления хрома +6 в гидроксиде хрома (VI) обусловливает сильное кулоновское притяжение между гидроксид-ионом и центральным атомом хрома и невозможность диссоциации по связи 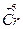 – OH. С другой стороны, высокая степень окисления хрома в гидроксиде хрома (VI) усиливает его способность притягивать электроны, т.е. электроотрицательность, что обусловливает высокую степень поляризации связей Н–О в этом соединении, являясь предпосылкой увеличения кислотности.
– OH. С другой стороны, высокая степень окисления хрома в гидроксиде хрома (VI) усиливает его способность притягивать электроны, т.е. электроотрицательность, что обусловливает высокую степень поляризации связей Н–О в этом соединении, являясь предпосылкой увеличения кислотности.
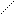
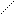
 Н–О +6 O
Н–О +6 O


 Cr
Cr
Н–О O
Следующей важной характеристикой атомов является их радиусы. В периодах радиусы атомов металлов с ростом порядкового номера элемента уменьшаются, т.к. с ростом порядкового номера элемента в пределах периода возрастает заряд ядра, а следовательно и уравновешивающий его общий заряд электронов; как следствие, возрастает и кулоновское притяжение электронов, что приводит в конечном счете к уменьшению расстояния между ними и ядром. Наиболее рельефно снижение радиуса наблюдается у элементов малых периодов, у которых происходит заполнение электронами внешнего энергетического уровня.
В больших периодах у d- и f-элементов наблюдается более плавное снижение радиусов при увеличении заряда ядра атома. В пределах каждой подгруппы элементов радиусы атомов, как правило, увеличиваются сверху вниз, так как такое смещение означает переход на более высокий энергетический уровень.
Влияние радиусов ионов элементов на свойства образуемых ими соединений можно проиллюстрировать на примере возрастания кислотности галогенводородных кислот в газовой фазе: HI > HBr > HCl > HF.
В этих соединениях сила кулоновского притяжения зависит от кулоновского радиуса, представляющего собой сумму радиусов ионов галогена и водорода. Очевидно, что с ростом радиуса галогена сила кулоновского притяжения снижается, что делает отщепление протона более выгодным.
