Вплив температури на швидкість реакції
У три пробірки наливають по 5 мл розчину Na2S2O3, а в інші три – по 5 мл розчину H2SO4. Залежно від вмісту пробірки групують у пари (кислота – тіосульфат). Термометр і першу пару пробірок поміщають у склянку з водою кімнатної температури. Через 3 – 5 хв зливають вміст однієї пробірки в другу, струшують та фіксують час від початку змішування до появи білої каламуті.
Другу пару пробірок поміщають у воду, температура якої на 10 оС вища, ніж у попередньому досліді, третю – у водне середовище, де температура ще на 10 оС вища.
Останні два досліди проводять аналогічно першому. Усі дані заносять у табл. 6.
Таблиця 6
| № досліду | Т , oC | 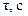 | 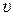 =1/ =1/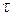 | g  |
За результатами одержаних даних роблять відповідний висновок.
Контрольні питання й завдання для самостійної роботи
1. Як зміниться швидкість реакції при зростанні температури від 50 до 100 оС, якщо температурний коефіцієнт дорівнює 2?
2. Яким чином зміниться швидкість реакції 2NO + O2 = 2NO2, коли збільшити концентрацію NO і O2 в 3 рази?
3. Температурний коефіцієнт швидкості реакції дорівнює 2,4. При якій температурі треба проводити реакцію для зниження її швидкості в 10 разів (початкова температура реакції 60 оС)?
4. Що являє собою поняття хімічної кінетики?
5. Дайте визначення швидкості хімічних реакцій.
6. Наведіть математичний вираз для визначення швидкості хімічних реакцій.
7. Від яких факторів залежить швидкість хімічних реакцій?
8. Яким законом виражається залежність швидкості реакцій від концентрації реагуючих речовин? Подайте його математичне вираження.
9. За яким правилом визначається вплив температури на швидкість реакції? Якому математичному виразу він відповідає?
Лабораторна робота № 5
ВИЗНАЧЕННЯ КОНСТАНТИ ШВИДКОСТІ КАТАЛІТИЧНОГО РОЗКЛАДАННЯ ВОДЕНЬ ПЕРОКСИДУ
Теоретичні положення
Каталізаторами називають речовини, що змінюють швидкість реакції, а самі до її кінця залишаються хімічно та кількісно незмінними.
Розрізняють каталіз гомогенний і гетерогенний. У першому випадку реагуючі речовини й каталізатор перебувають в одній фазі, у другому – в різних. Велике значення при гетерогенному каталізі має адсорбція.
Каталіз набуває широкого застосування в практиці, зокрема для виробництва сульфатної та нітратної кислот, аміаку, різних органічних і високомолекулярних сполук. При цьому каталізаторами часто бувають платина, родій, залізо, оксиди ванадію, алюмінію, мангану та ін.
У даній роботі пропонується виміряти швидкість розкладання водень пероксиду за наявності каталізатора при кімнатній температурі. Реакція розкладання може бути записана у вигляді таких рівнянь:
Н2О2 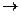 Н2О+О; (1)
Н2О+О; (1)
2О 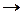 О2 (2)
О2 (2)
Можна припустити, що сумарна швидкість реакції визначається першою стадією як більш повільною, тому її величина залежить від концентрації водень пероксиду, а саме:
V1 = k1 C (Н2О2) (3)
У розведених розчинах його розкладання зумовлене нестійкістю самих молекул Н2О2 і відбувається за рівнянням (1). Отже, розкладання водень пероксиду являє собою реакцію першого порядку.
Вимірювання швидкості розкладання водень пероксиду базується на визначенні його концентрації в будь-який момент. Через постійне зменшення концентрації Н2О2 швидкість реакції поступово зменшується, тому вона максимальна на початку реакції і прямує до нуля в кінці реакції. Спостерігати зміну швидкості реакції зручніше за об'ємом кисню, що виділяється.
У зв’язку з тим, що швидкість розкладання пероксиду в розведених розчинах невелика, реакцію здійснюють в присутності каталізатора – манган (ІV) оксиду.
Мета роботи – закріпити теоретичні знання з розділу «Хімічна кінетика».
Постановка завдання
Визначити: швидкість розкладання водень пероксиду в розведених розчинах за наявності каталізатора.
Приладдя та реактиви: прилад для визначення молярної маси еквівалента металу, мірний циліндр, скляна паличка, 3%-ний розчин водень пероксиду, дистильована вода, клей БФ, каталізатор (порошок МnО2). .
Методика дослідження
Кількість водень пероксиду, що розклався в даний момент, визначають на приладі, що використовувався при визначенні молярної маси еквівалента металу (рис.1).
Скляну паличку довжиною 1 – 2 см занурюють самим кінчиком у розчин колодію чи клею БФ. Дають стекти надлишку клею, потім торкаються ним поверхні тонко подрібненого порошку МnО2 – каталізатора, щоб кілька його частинок прилипло до палички. Дають підсохнути 5 – 10 хв.
За допомогою мірного циліндра наливають у пробірку 3 мл
3%-ного розчину Н2О2 і додають 5 мл дистильованої води.
Перевіряють прилад на герметичність. Доводять тиск у пробірці до атмосферного (рівень води в бюретці та воронці повинен бути однаковим). Записують покази рівня.
Від'єднують пробірку від приладу й опускають у її бічне відгалуження скляну паличку з каталізатором. Тримаючи пробірку в похилому положенні, приєднують її до приладу. Встановлюють пробірку вертикально, щоб паличка з каталізатором опинилась на дні пробірки, й одночасно секундоміром визначають час початку реакції. Кисень, що виділяється внаслідок розкладання Н2О2, витісняє воду з бюретки. Воронку при цьому опускають і під час досліду намагаються підтримувати рівень води в ній та в бюретці однаковим, щоб тиск газу всередині приладу був увесь час близьким до атмосферного. Перші 10 хв записують покази рівня води в бюретці щохвилини, протягом наступних
10 хв – кожні 2 хв і ще півгодини – кожні 5 хв. Дослід можна закінчити, коли за 10 хв рівень води в бюретці змінюється не більш ніж на 0,1 – 0,2 мл.
До кінця досліду реакція значно сповільнюється і щоб визначити об'єм кисню, який виділився внаслідок практично повного розкладання Н2О2, потрібні були б десятки годин. Щоб прискорити кінець реакції, пробірку із реакційною сумішшю, не від'єднуючи від приладу, опускають у склянку з гарячою водою (80 – 90 оС).
Після закінчення реакції (приблизно через 10 – 15 хв) приладу дають охолонути, доводять тиск до атмосферного і записують об'єм кисню, який виділився.
