Тема 12 ЗАГАЛЬНІ ВЛАСТИВОСТІ МЕТАЛІВ
Приклад 1. Чим відрізняються кристалічні гратки металів від: а) йонних; б) атомних?
Відповідь:
Кристалічні гратки металів утворюються тільки позитивними йонами. Йонні – як позитивними, так і негативно зарядженими йонами. Тип зв’язку в кристалічних гратках металів – металічний, а в атомних – ковалентний.
Будова кристалічних граток металів обумовлюється їх фізичними і хімічними властивостями. Завдяки рухливим електронам метали мають високу тепло- і електропровідність. Поскільки метали легко віддають зовнішні електрони, тому вони є сильними відновниками.
Питання 2. Які загальні фізичні властивості металів? Поясніть ці властивості, ґрунтуючись на уявленнях про металічний зв’язок.
Відповідь:
Фізичні властивості металів: металічний блиск, висока тепло- і електропровідність, ковкість і пластичність. Провідність тепла і електрики пояснюється рухом вільних електронів в кристалічній гратці металів. Ковкість і пластичність металів пояснюється рухом окремих шарів йонів один відносно іншого. Густина металів, температури їх плавлення і кипіння відрізняються і залежать від міцності металічного зв’язку.
Питання 3. Чому деякі метали пластичні (наприклад, мідь), а інші – крихкі (наприклад, стибій)?
Відповідь:
Атоми крихких металів мають число вільних електронів від п’яти до семи. Ці електрони забезпечують міцну взаємодію між окремими шарами йонів і запобігають їх ковзанню один відносно іншого. Взаємодія між йонними шарами у пластичних металів мала, оскільки число вільних електронів між шарами менше, ніж у крихких металів.
Приклад 4. На основі вчення про будову атомів поясність, чим метали за хімічними властивостями відрізняються від неметалів.
Відповідь:
Основна відмінність металів від неметалів та, що атоми металів легко віддають свої валентні електрони, тобто є сильними відновниками. Метали окиснюються окисниками: киснем, воднем, галогенами, сіркою, гідроген-іонами та йонами інших металів.
Приклад 5.Чому метали взаємодіють з неметалами? Напишіть рівняння реакцій, вкажіть які продукти реакцій утворюються.
Відповідь:
Хімічні властивості металів визначаються здатністю їх атомів легко віддавати валентні електрони і перетворюватись на позитивні йони внаслідок низьких значень електронегативностей, які обумовлені невеликими енергіями йонізації та спорідненістю до електрона (часто від’ємною). Приклади взаємодії металів з неметалами:
| Реагент (неметал) | Рівняння реакцій | Продукти реакцій |
| Кисень | 2Ca + O2 → 2CaO 4Fe + 3O2 →2 Fe2O3 2Na + O2 → Na2O2 | оксид або пероксид |
(з киснем реагують усі метали, крім золота, срібла, платинових металів).
| Сірка | Fe + S → FeS | сульфід |
(з сіркою реагують усі метали, крім золота та платини).
| Хлор | 2Fe + 3Cl2 → 2FeCl3 2Au + 3Cl2 → 2AuCl3 | хлорид |
(реагують - всі).
| Азот | 6Na + N2 → 2Na3N | нітрид |
(реагують тільки лужні, магній та лужноземельні).
| Фосфор | 3Mg + 2P → Ca3P2 3Na + P → Na3P | фосфід |
(реагують майже всі)
| Вуглець | 4Al + 3C → Al4C3 3Fe + C → Fe3C | карбід |
(реагують майже всі)
| Кремній | 2Ca + Si → Ca2Si | силіцид |
(реагують майже всі)
| Водень | 2La + 3H2 → 2LaH3 | гідрид |
(реагують майже всі).
Приклад 6.Як взаємодіють метали з водою? Напишіть рівняння відповідних реакцій.
Відповідь:
По відношенню до води та водних розчинів метали діляться на активні, пасивуючі та інертні. Всі метали, які знаходяться в ряду активності до водню повинні витісняти його з води. В дійсності - витісняють тільки активні метали, решта не витісняють, тому що:
1. Метали покриваються оксидною плівкою, яка захищає їх від розчинення.
2. Ряд активності справджується для 1 моль∙екв./лрозчинів, а концентрація йонів H+ у воді тільки 10-7 моль/л, надзвичайно мала.
З водою при звичайній температурі взаємодіють лужні та лужноземельні метали і талій. При цьому утворюються відповідні гідроксиди і виділяється водень. Наприклад:
2Tl + 2H2O = 2TlOH + H2
Ca + 2H2O = Ca(OH)2 + H2
При нагріванні з водою взаємодіють також магній та берилій:
Mg + 2H2O = Mg(OH)2 + H2
Be + 2H2O = Вe(ОН)2 + H2
Метали підгрупи скандію і лантаноїди теж реагують з водою, хоча іповільно:
2Sc + 6H2O = 2Sc(OH)3 + ЗH2↑
При взаємодії калію з водою загоряється водень, реакція Rb і Cs супроводжується вибухом.
Алюміній, галій, індій, германій, олово, свинець, стибій і бісмут при високих температурах взаємодіють з водяною парою, при цьому виділяється водень і утворюються відповідні оксиди, в яких метали проявляють свої стійкі ступені окиснення.
Наприклад : Pb + H2O = PbO + H2
Деякі метали здатні взаємодіяти зводою не витісняючи з неї водню. Це пояснюється тим, що вони утворюють погано розчинні у воді гідроксиди, які осідають на поверхню металу і утворюють на ній захисні плівки. Наприклад, магній, який спочатку взаємодіє з водою, потім покривається нерозчинним гідроксидом:
Mg + 2H2O = Mg(OH)2 + H2↑
Якщо ж гідроксид нестійкий, то він на поверхні металу розпадається і утворює захисну плівку оксиду, наприклад, Al2O3, Сr2О3, на цинку у вигляді ZnO і т.д. Зменшення активності металу за рахунок утворення захисних плівок називається пасивацією. При видаленні захисної плівки метал реагує з водою.
З металів побічних підгруп, з водою, при нагріванні взаємодіють тільки елементи третьої побічної підгрупи. При цьому виділяється водень і утворюються практично нерозчинні у воді гідроксиди :
2La + 6H2О = 2La(ОH)3 + ЗН2
Інші d-метали, за винятком найменш активних (технецію, ренію, металів родини платини, металів побічної підгрупи першої групи та ртуті), взаємодіють при високих температурах з водяною парою. При цьому виділяється водень і утворюються відповідні оксиди або гідроксиди:
2Cr + ЗН2О = Сr2О3 +3H2
Mn + 2H2O = Mn(OH)2 + Н2
При нагріванні лантаноїди взаємодіють з водою, при цьому утворюються нерозчинні у воді гідроксиди :
2Lа + 6H2O = 2Lа(OH)3 + 3H2,
де Ln - атом лантаноїду. Цей процес краще відбувається з металами церієвої групи. Уран і торій взаємодіють з водяною парою при температурі 200-3000C, при цьому водень, щоутворюється, реагує з металом, утворюючи гідрид:
U + 2H2O = UO2 + 2Н2↑
2U + 3H2 = 2UH3
Приклад 7. Як взаємодіють метали з лугами ? Напишіть рівняння відповідних реакцій.
Відповідь:
3 лугами взаємодіють тільки ті метали, оксиди якихволодіють амфотерними властивостями. При дії лугу на цинк одержується сіль цинкової кислоти - цинкат з виділенням водню, яке пов’язується з взаємодією атомів металу з молекулами води
Zn + Н2О = Zn(OH)2 + Н2
Роль лугу полягає в розчиненні захисної плівки
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Сумарно записують:
Zn + 2NaОН + 2H2O = Na2[Zn(OH)4] + H2↑
2Al + 2NaОН + 6H2O = 2Na[Al(OH)4] + 3H2↑
або 2Al + 2NaОН + 2H2O= 2NaAlO2 + 3H2↑
Берилій, алюміній, галій, індій, олово й свинець розчиняються у лугах, причому олово й свинець краще, при нагріванні, з утворенням відповідних гідроксосолей:
Be + 2KОН + 2H2O = K2[Be(OH)4] + H2↑
2Al + 2KОН + 6H2O= 2K[Al(OH)4] + 3H2↑
Pb + 2KОН + 2H2O = K2[Pb(OH)4] + H2↑
Sn + 2KОН + 4H2O = K2[Sn(OH)6] + 2H2↑
Всі інші елементів головних підгруп у лугах нерозчинні.
Деякі метали побічних підгруп добре розчинні у лугах, зокрема цинк. Титан, цирконій, а також ванадій, ніобій і тантал повільно взаємодіють при нагріванні з концентрованими розчинами лугів, окиснюючись до вищих ступенів окиснення і утворюючи солі відповідних кислот :
Ti + 2KOH + H2O = K2TiO3 +2H2
2V + 2KOH + 4H2O = 2KVO3 + 5H2
Хром, вольфрам, реній і метали родини платини взаємодіють при високій температурі з розтопленими лугами в присутності окисників (кисню, калій нітрату KNO3, калій перхлорату KClO4 тощо):
W + 2KOH + 3KNO3 = K2WO4 + KNO2 + H2O
З лугами за звичайних умовлантаноїди й актиноїди не взаємодіють.
Приклад 8. Як реагують метали з найбільш вживаними кислотами HCl, HNO3, H2SO4?
Відповідь:
Майже всі метали окиснюються кислотами. Характер взаємодії з кислотою залежить від активності металу, його властивостей, а також від концентрації кислоти.
При взаємодії безоксигенової кислоти з металом, роль окислювача відіграє йон гідрогену Н+. Якщо ж з металом реагує оксигеновмісна кислота, то в ролі окислювача виступає Н+, або аніон кислотного залишку.
Хлоридна кислота HCl сильна кислота (α = 99%), вона містить 38% HCl у водному розчині (більше гідроген хлориду у воді не розчиняється).
Хлороводнева кислота – слабкий окисник за рахунок йонів Н+ , тому вона взаємодіє лише з металами, які стоять в ряду стандартних електродних потенціалів перед воднем, наприклад:
2 HCl + Mg → MgCl2 + H2↑
HCl + Cu ≠
Схема взаємодії сульфатної кислоти з металами:
|
|
|
|
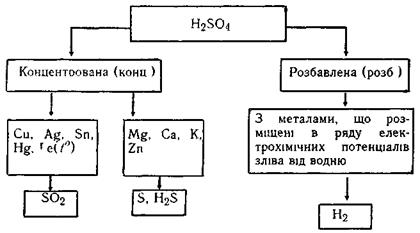
Приклади:
Під час взаємодії з активними металами (наприклад, із магнієм) в залежності від концентрації і температури паралельно відбуваються кілька реакцій з утворенням сполук сірки, в яких сірка має різні ступені окиснення (S+4O2, S0,
H2S-2); однак переважають реакції з утворенням S0 і H2S.
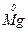 +
+ 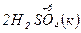 =
= 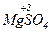 +
+ 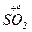 + 2H2O
+ 2H2O
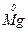 – 2e → – 2e → 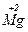 | відновник | |
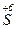 + 2e → + 2e → 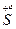 | окисник |
8 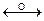 8
8
3 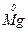 +
+ 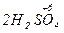 = 3
= 3 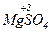 +
+ 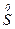 + 4H2O
+ 4H2O
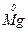 – 2e → – 2e → 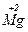 | відновник | ||
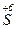 + 6e → + 6e → 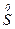 | окисник |
16 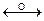 16
16
4 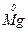 +
+ 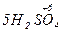 = 4
= 4 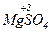 +
+ 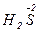 + 4H2O
+ 4H2O
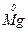 – 2e → – 2e → 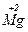 | відновник | ||
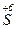 + 8e → + 8e → 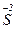 | окисник |
20  20
20
Внаслідок взаємодії з малоактивними металами (наприклад, міддю) утворюються сіль та сульфур (ІV):оксид
Cu + 2H2SO4(к) → CuSO4 + SO2 + 2H2O
У випадку розведеної сульфатної кислоти метали реагують з нею аналогічно хлоридній кислоті, тобто виділяється водень:
Zn + H2SO4 (р) → ZnSO4 + H2↑
Нітратна кислота – сильний окисник. Внаслідок взаємодії з металами водень не виділяється, він окислюється з утворенням води.
Схема взаємодії нітратної кислоти з металами:

Приклади:
a) 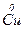 + 4
+ 4 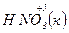 =
= 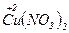 + 2
+ 2 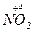 + 2H2O
+ 2H2O
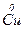 – 2e → – 2e → 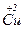 | відновник | ||
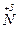 + e → + e → 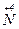 | окисник |
12  12
12
б) 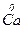 + 10Н
+ 10Н 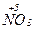 (к) = 4
(к) = 4 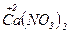 +
+ 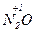 + 5H2O
+ 5H2O
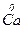 – 2e → – 2e → 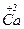 | відновник | ||
2 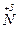 + 8e → 2 + 8e → 2 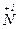 | окисник |
30  30
30
в) 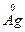 + 4H
+ 4H 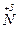 O3(р) = 3
O3(р) = 3 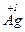 NO3 +
NO3 + 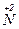 O + 2H2O
O + 2H2O
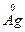 –e → –e → 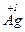 | відновник | ||
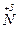 + 3e → + 3e → 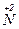 | окисник |
12 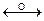 12
12
г) 4 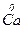 + 10 H
+ 10 H 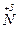 O3 (Р) = 4
O3 (Р) = 4 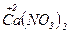 +
+ 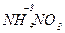 + 3H2O
+ 3H2O
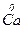 – 2e → – 2e → 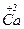 | відновник | ||
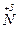 + 8e → + 8e → 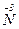 | окисник |
30  30
30
Не реагуєнітратна кислота з платиною (Pt), золотом (Au), радієм (Rh), талієм (Tl), іридієм (Ir), пасивує(при звичайній температурі): алюміній (Al), хром (Cr), залізо (Fe).
Приклад 9. Як можна встановити, що при горінні металічного натрію утворюється не оксид, а пероксид?
Відповідь:
Натрій пероксид, на відміну від оксиду, сильний окисник, він окислює йодиди в кислому середовищі до йоду.
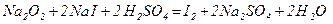 .
.
Натрій оксид реагує не з 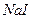 , а із
, а із 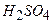 .
.
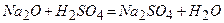 .
.
Приклад 10. Атоми яких елементів є більш сильними відновниками – лужні метали чи водень? Підвердіть відповідь рівняннями реакцій.
Відповідь:
Лужні метали – більш сильні відновники, ніж водень. Це підтверджується тим, що вони витісняють водень із води і кислот:
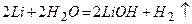 ;
;
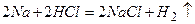 .
.
Приклад 11 Чому у фотоелементах використовують переважно цезій а не літій?
Відповідь:
Енергія йонізації атома цезію – найменша серед всіх лужних металів (за виключенням радіоактивного францію), тому при опроміненні цезію з його поверхні легко відриваються електрони, які використовуються у фотоелементах.
Приклад 12. Напишіть рівняння реакцій, які дозволяють здійснити наступні перетворення:
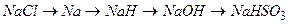 .
.
Відповідь:
1) натрій утворюються під час електролізу розплаву натрій хлориду
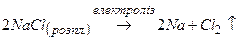 ;
;
2) натрій реагує із воднем:
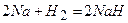 .
.
3) натрій гідрид повністю гідролізується:
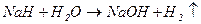 .
.
4) при пропусканні надлишку сульфур (IV) оксиду через розчин натрій гідроксиду утворюється натрій гідросульфіт
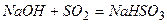 .
.
Приклад 13. Напишіть рівняння реакцій:
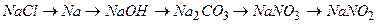 .
.
Відповідь:
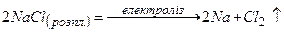 ;
;
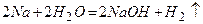 ;
;
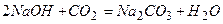 ;
;
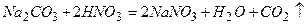 ;
;
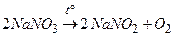 ↑.
↑.
Приклад 14. У вашому розпорядженні натрій хлорид і вода. Які речовини можна отримати із цих речовин, використовуючи необхідні прилади?
Відповідь:
1) 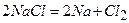 ;
;
2) 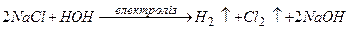 .
.
3) 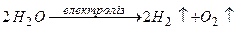 .
.
4) 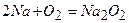 .
.
5) 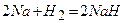 .
.
6) 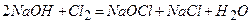 .
.
7) 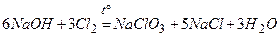 .
.
8) 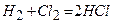 .
.
9) 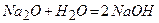 .
.
10) 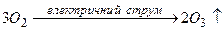 .
.
11) 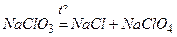 .
.
Приклад 15. Напишіть рівняння реакцій взаємодії лужних металів з киснем
Відповідь:
Всі лужні метали легко окиснюються киснем повітря, причому літій утворює оксид:
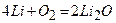 ;
;
натрій пероксид:
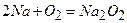 ;
;
калій, рубідій та цезій – надпероксиди
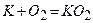 .
.
Приклад 16. Металічний кальцій твердіший за літій, але м’якший від берилію. Як це можна пояснити, ґрунтуючись на вченні про будову кристалічних ґраток.
Відповідь:
Кальцій твердіший за літій, оскільки він має два електрони на зовнішньому рівні, а літій – один, і тому в утворенні металічного зв’язку в кальцію беруть участь більше число електронів, ніж у літію. Значить, металічний зв’язок в кальцію міцніший, ніж у літію, тому кальцій твердіший.
Атом берилію має менший радіус, ніж атом кальцію, тому в металічного берилію шари йонів міцніше зв’язані один з одним, ніж у металічного кальцію. Значить, берилій твердіший, ніж кальцій
Ці приклади свідчать про те, що твердість металу однозначно пов’язана з міцністю металічного зв’язку.
