Законы радиоактивного распада.
Законы радиоактивного распада ядер
Способность ядер самопроизвольно распадаться, испуская частицы, называется радиоактивностью. Радиоактивный распад - статистический процесс. Каждое радиоактивное ядро может распасться в любой момент и закономерность наблюдается только в среднем, в случае распада достаточно большого количества ядер.
Постоянная распада λ - вероятность распада ядра в единицу времени.
Если в образце в момент времени t имеется Nрадиоактивных ядер, то количество ядер dN, распавшихся за время dt пропорционально N.
dN = -λNdt. (13.1)
Проинтегрировав (1) получим закон радиоактивного распада
N(t) = N0e-λt. (13.2)
N0 - количество радиоактивных ядер в момент времени t = 0.
Cреднее время жизни τ –
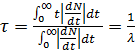 . (13.3)
. (13.3)
Период полураспада T1/2 - время, за которое первоначальное количество радиоактивных ядер уменьшится в два раза
T1/2 = ln2/λ=0.693/λ = τln2. (13.4)
Активность A - среднее количество ядер распадающихся в единицу времени
A(t) = λN(t). (13.5)
Активность измеряется в кюри (Ки) и беккерелях (Бк)
1 Ки = 3.7*1010 распадов/c, 1 Бк = 1 распад/c.
Распад исходного ядра 1 в ядро 2, с последующим его распадом в ядро 3, описывается системой дифференциальных уравнений
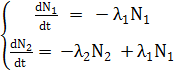 (13.6)
(13.6)
гдеN1(t) и N2(t) -количество ядер, а λ1 иλ2 - постоянные распада ядер 1 и 2 соответственно. Решением системы (6) с начальными условиями N1(0) = N10; N2(0) = 0 будет
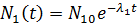 , (13.7a)
, (13.7a)
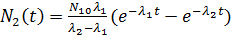 . (13.7б)
. (13.7б)
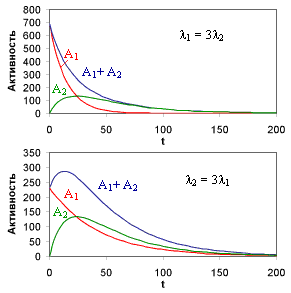
| Рисунок 13. 1 |
Количество ядер 2 достигает максимального значения
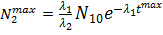 при
при 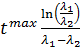 .
. Если λ2 < λ1 ( 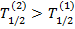 ), суммарная активностьN1(t)λ1 + N2(t)λ2 будет монотонно уменьшаться.
), суммарная активностьN1(t)λ1 + N2(t)λ2 будет монотонно уменьшаться.
Если λ2 >λ1 ( 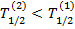 )), суммарная активность вначале растет за счет накопления ядер 2.
)), суммарная активность вначале растет за счет накопления ядер 2.
Если λ2 >> λ1, при достаточно больших временах вклад второй экспоненты в (7б) становится пренебрежимо мал, по сравнению со вкладом первой и активности второго A2 = λ2N2 и первого изотопов A1 = λ1N1 практически сравняются. В дальнейшем активности как первого так и второго изотопов будут изменяться во времени одинаково.
A1(t) = N10λ1 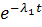 = N1(t)λ1 = A2(t) = N2(t)λ2. (13.8)
= N1(t)λ1 = A2(t) = N2(t)λ2. (13.8)
То есть устанавливается так называемое вековое равновесие, при котором число ядер изотопов в цепочке распадов связано с постоянными распада (периодами полураспада) простым соотношением.
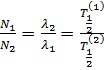 . (13.9)
. (13.9)
Поэтому в естественном состоянии все изотопы, генетически связанные в радиоактивных рядах, обычно находятся в определенных количественных соотношениях, зависящих от их периодов полураспада.
В общем случае, когда имеется цепочка распадов 1→2→...n, процесс описывается системой дифференциальных уравнений
dNi/dt = -λiNi +λi-1Ni-1. (13.10)
Решением системы (10) для активностей с начальными условиями N1(0) = N10; Ni(0) = 0 будет
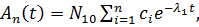 (13.11)
(13.11)
где
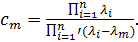 (13.12)
(13.12)
Штрих означает, что в произведении, которое находится в знаменателе, опускается множитель с i = m.
Изотопы
ИЗОТОПЫ–разновидности одного и того же химического элемента, близкие по своим физико-химическим свойствам, но имеющие разную атомную массу. Название «изотопы» было предложено в 1912 английским радиохимиком Фредериком Содди, который образовал его из двух греческих слов: isos – одинаковый и topos – место. Изотопы занимают одно и то же место в клетке периодической системы элементов Менделеева.
Атом любого химического элемента состоит из положительно заряженного ядра и окружающего его облака отрицательно заряженных электронов (см.также АТОМА ЯДРО). Положение химического элемента в периодической системе Менделеева (его порядковый номер) определяется зарядом ядра его атомов. Изотопаминазываются поэтомуразновидности одного и того же химического элемента, атомы которых имеют одинаковый заряд ядра (и, следовательно, практически одинаковые электронные оболочки), но отличаются значениями массы ядра. По образному выражению Ф.Содди, атомы изотопов одинаковы «снаружи», но различны «внутри».
В 1932 был открыт нейтрон – частица, не имеющая заряда, с массой, близкой к массе ядра атома водорода – протона, и созданапротонно-нейтронная модель ядра.В результатев науке установилось окончательное современное определение понятия изотопов: изотопы – это вещества, ядра атомов которых состоят из одинакового числа протонов и отличаются лишь числом нейтронов в ядре. Каждый изотоп принято обозначать набором символов 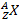 , где X – символ химического элемента, Z – заряд ядра атома (число протонов), А – массовое число изотопа (общее число нуклонов – протонов и нейтронов в ядре, A = Z + N). Поскольку заряд ядра оказывается однозначно связанным с символом химического элемента, часто для сокращения используется просто обозначение AX.
, где X – символ химического элемента, Z – заряд ядра атома (число протонов), А – массовое число изотопа (общее число нуклонов – протонов и нейтронов в ядре, A = Z + N). Поскольку заряд ядра оказывается однозначно связанным с символом химического элемента, часто для сокращения используется просто обозначение AX.
Из всех известных нам изотопов только изотопы водорода имеют собственные названия. Так, изотопы 2H и 3H носят названия дейтерия и трития и получили обозначения соответственно D и T (изотоп 1H называют иногда протием).
В природе встречаются как стабильные изотопы, так и нестабильные – радиоактивные, ядра атомов которых подвержены самопроизвольному превращению в другие ядра с испусканием различных частиц (или процессам так называемого радиоактивного распада). Сейчас известно около 270 стабильных изотопов, причем стабильные изотопы встречаются только у элементов с атомным номером Z Ј 83. Число нестабильных изотопов превышает 2000, подавляющее большинство их получено искусственным путем в результате осуществления различных ядерных реакций. Число радиоактивных изотопов у многих элементов очень велико и может превышать два десятка. Число стабильных изотопов существенно меньше, Некоторые химические элементы состоят лишь из одного стабильного изотопа (бериллий, фтор, натрий, алюминий, фосфор, марганец, золото и ряд других элементов). Наибольшее число стабильных изотопов – 10 обнаружено у олова, у железа, например, их – 4, у ртути – 7.
Открытие изотопов, историческая справка.В 1808 английский ученый натуралист Джон Дальтон впервые ввел определение химического элемента как вещества, состоящего из атомов одного вида. В 1869 химиком Д.И. Менделеевым была открыт периодический закон химических элементов. Одна из трудностей в обосновании понятия элемента как вещества, занимающего определенное место в клетке периодической системы, заключалась в наблюдаемой на опыте нецелочисленности атомных весов элементов. В 1866 английский физик и химик – сэр Вильям Крукс выдвинул гипотезу, что каждый природный химический элемент представляет собой некоторую смесь веществ, одинаковых по своим свойствам, но имеющих разные атомные масс, однако в то время такое предположение не имело еще экспериментального подтверждения и поэтому прошло мало замеченным.
Важным шагом на пути к открытию изотопов стало обнаружение явления радиоактивности и сформулированная Эрнстом Резерфордом и Фредериком Содди гипотеза радиоактивного распада:радиоактивность есть не что иное, как распад атома на заряженную частицу и атом другого элемента, по своим химическим свойствам отличающийся от исходного. В результате возникло представление о радиоактивных рядах или радиоактивных семействах, в начале которых есть первый материнский элемент, являющийся радиоактивным, и в конце – последний стабильный элемент. Анализ цепочек превращений показал, что в их ходе в одной клеточке периодической системы могут оказываться одни и те же радиоактивные элементы, отличающиеся лишь атомными массами. Фактически это и означало введение понятия изотопов.
Независимое подтверждение существования стабильных изотопов химических элементов было затем получено в экспериментах Дж. Дж. Томсона и Астона в 1912–1920 с пучками положительно заряженных частиц (или так называемых каналовых лучей), выходящих из разрядной трубки.
В 1919 Астон сконструировал прибор, названный масс-спектрографом(илимасс-спектрометром). В качестве источника ионов по-прежнему использовалась разрядная трубка, однако Астон нашел способ, при котором последовательное отклонение пучка частиц в электрическом и магнитном полях приводило к фокусировке частиц с одинаковым значением отношения заряда к массе (независимо от их скорости) в одной и той же точке на экране. Наряду с Астоном масс-спектрометр несколько другой конструкции в те же годы был создан американцем Демпстером. В результате последующего использования и усовершенствования масс-спектрометров усилиями многих исследователей к 1935 году была составлена почти полная таблица изотопных составов всех известных к тому времени химических элементов.
Методы разделения изотопов.Для изучения свойств изотопов и особенно для их применения в научных и прикладных целях требуется их получение в более или менее заметных количествах. В обычных масс-спектрометрах достигается практически полное разделение изотопов, однако количество их ничтожно мало. Поэтому усилия ученых и инженеров были направлены на поиски других возможных методов разделения изотопов. В первую очередь были освоены физико-химические методы разделения, основанные на различиях в таких свойствах изотопов одного итого же элемента, как скорости испарения, константы равновесия, скорости химических реакций и т.п. Наиболее эффективными среди них оказались методы ректификации и изотопного обмена, которые нашли широкое применение в промышленном производстве изотопов легких элементов: водорода, лития, бора, углерода, кислорода и азота.
Другую группу методов образуют так называемые молекулярно-кинетические методы: газовая диффузия, термодиффузия, масс-диффузия (диффузия в потоке пара), центрифугирование. Методы газовой диффузии, основанные на различной скорости диффузии изотопных компонентов в высокодисперсных пористых средах, были использованы в годы второй мировой войны при организации промышленного производства разделения изотопов урана в США в рамках так называемого Манхэттенского проекта по созданию атомной бомбы. Для получения необходимых количеств урана, обогащенного до 90% легким изотопом 235U – главной «горючей» составляющей атомной бомбы, были построены заводы, занимавшие площади около четырех тысяч гектар. На создание атомного центра с заводами для получения обогащенного урана было ассигновано более 2-х млрд. долл. После войны в СССР были разработать и построены заводы по производству обогащенного урана для военных целей, также основанные на диффузионном методе разделения. В последние годы этот метод уступил место более эффективному и менее затратному методу центрифугирования. В этом методе эффект разделения изотопной смеси достигается за счет различного действия центробежных сил на компоненты изотопной смеси, заполняющей ротор центрифуги, который представляет собой тонкостенный и ограниченный сверху и снизу цилиндр, вращающийся с очень высокой скоростью в вакуумной камере. Сотни тысяч соединенных в каскады центрифуг, ротор каждой из которых совершает более тысячи оборотов в секунду, используются в настоящее время на современных разделительных производствах как в России, так и в других развитых странах мира. Центрифуги используются не только для получения обогащенного урана, необходимого для обеспечения работы ядерных реакторов атомных электростанций, но и для производства изотопов примерно тридцати химических элементов средней части периодической системы. Для разделения различных изотопов используются также установки электромагнитного разделения с мощными источниками ионов, в последние годы получили распространение также лазерные методы разделения.
Применение изотопов.Разнообразные изотопы химических элементов находят широкое применение в научных исследованиях, в различных областях промышленности и сельского хозяйства, в ядерной энергетике, современной биологии и медицине, в исследованиях окружающей среды и других областях. В научных исследованиях (например, в химическом анализе) требуются, как правило, небольшие количества редких изотопов различных элементов, исчисляемые граммами и даже миллиграммами в год. Вместе с тем, для ряда изотопов, широко используемых в ядерной энергетике, медицине и других отраслях, потребность в их производстве может составлять многие килограммы и даже тонны. Так, в связи с использованием тяжелой воды D2O в ядерных реакторах ее общемировое производство к началу 1990-х прошлого века составляло около 5000 т в год. Входящий в состав тяжелой воды изотоп водорода дейтерий, концентрация которого в природной смеси водорода составляет всего 0,015%, наряду с тритием станет в будущем, по мнению ученых, основным компонентом топлива энергетических термоядерных реакторов, работающих на основе реакций ядерного синтез. В этом случае потребность в производстве изотопов водорода окажется огромной.
В научных исследованиях стабильные и радиоактивные изотопы широко применяются в качестве изотопных индикаторов (меток) при изучении самых различных процессов, происходящих в природе.
В сельском хозяйстве изотопы («меченые» атомы) применяются, например, для изучения процессов фотосинтеза, усвояемости удобрений и для определения эффективности использования растениями азота, фосфора, калия, микроэлементов и др. веществ.
Изотопные технологии находят широкое применение в медицине. Так в США, согласно статистическим данным, проводится более 36 тыс. медицинских процедур в день и около 100 млн. лабораторных тестов с использованием изотопов. Наиболее распространены процедуры, связанные с компьютерной томографией. Изотоп углерода C13, обогащенный до 99% (природное содержание около 1%), активно используется в так называемом «диагностическом контроле дыхания». Суть теста очень проста. Обогащенный изотоп вводится в пищу пациента и после участия в процессе обмена веществ в различных органах тела выделяется в виде выдыхаемого пациентом углекислого газа СО2, который собирается и анализируется с помощью спектрометра. Различие в скоростях процессов, связанных с выделением различных количеств углекислого газа, помеченных изотопом С13, позволяют судить о состоянии различных органов пациента. В США число пациентов, которые будут проходить этот тест, оценивается в 5 млн. человек в год. Сейчас для производства высоко обогащенного изотопа С13 в промышленных масштабах используются лазерные методы разделения.
