Факторы, влияющие на скорость химических реакций
Химическая кинетика
Кинетика химических реакций - учение о химических процессах, о законах их протекания во времени, скоростях и механизмах. С исследованиями кинетики химических реакций связаны важнейшие направления современной химии и химической промышленности: разработка рациональных принципов управления химическими процессами; стимулирование полезных, торможение и подавление нежелательных химических реакций; создание новых и усовершенствование существующих процессов и аппаратов в химической технологии; изучение поведения химических продуктов, материалов и изделий из них в различных условиях применения и эксплуатации.
Основные понятия и законы
Система- совокупность находящихся во взаимодействии веществ, мысленно (или фактически) обособленная от окружающей среды.
Фаза-это часть системы, однородная во всех точках по составу и свойствам и отделённая от других частей системы поверхностью раздела. Вещество может находиться в трёх фазах: жидкой, твёрдой и газообразной.
В зависимости от количества фаз все системы и реакции в них делят на гомогенныеи гетерогенные.Гомогенныереакции протекают в одной фазе (как правило- газовой). Например, реакция взаимодействия между хлором и водородом, приводящая к образованию хлороводорода (однофазная система):
Cl2 + H2=2HCl .
Гетерогенныереакции протекают на поверхности раздела фаз. Примером гетерогеннойреакции может служить реакция горения, протекающая на границе уголь-кислород (система, состоящая из двух фаз): С + О2=СО2 . При 0 °С лед, вода и находящийся над ними пар образуют гетерогенную систему из трех фаз: твердой — льда, жидкой — воды и газообразной — водяного пара.
Молекулярность реакцииопределяется числом молекул, участвующих в самой медленной, лимитирующей стадии. Реакции бывают моно-, би-, три- и т.д. молекулярными. Мономолекулярной называется такая реакция, в которой лимитирующей стадией является превращение одной молекулы, например, распад ее на составляющие (диссоциация молекул иода I2 = 2I) или превращение в другую молекулу в результате внутримолекулярной перестройки:

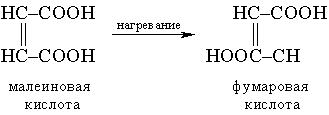 .
.
Бимолекулярная реакция – это взаимодействие двух молекул (например, молекулярного водорода с молекулярным иодом, H2 + I2 = 2HI). Реакция, протекающая одновременно с участием трех молекул, называется тримолекулярной. Поскольку вероятность столкновения сразу трех молекул, да еще в правильной взаимной ориентации, очень мала, такие реакции происходят редко.
Порядок реакции.Порядок реакции – это эмпирическая величина, равная сумме показателей степеней, с которыми концентрации реагентов входят в выражение для скорости реакции. Так, для реакции aA + bB = mM + nN
порядок реакции а + b.
Реакции первого порядка- это реакции, в которых скорость зависит от концентрации только одного реагента в первой степени. Уравнению первого порядка следуют многие химические реакции. Например, С2Н5ОН = С2Н4 + Н2О
Реакции второго порядка –это реакции, в которых скорость пропорциональна квадрату концентрации отдельного реагента или концентрациям каждого из двух реагирующих веществ в первой степени.
Например: 1) 2НВr = Н2 + Вr2или 2) CH3Br + KOH = CH3OH + KBr
Реакции третьего порядка - это реакции, в которых скорость может зависеть от концентрации одного реагента в третьей степени, либо концентрации одного реагента во второй степени и второго реагента в первой степени, либо от концентрации каждого из трех реагентов в первой степени.
Исследования кинетики различных взаимодействий показывают, что чаще других встречаются реакции 1-го, 2-го и иногда третьего порядков. Но существуют реакции и других порядков.
Реакции нулевого порядка-это реакции, в которых скорость не зависит от концентраций реагентов и определяется другими лимитирующими факторами, например, площадью поверхности катализатора (в реакциях гетерогенного катализа) или поглощением света (в фотохимических реакциях).
Как правило, для большинства простых реакций порядок реакции и её молекулярность совпадают и определяются вышеописанными способами. Но для реакций, протекающих в несколько стадий, порядок реакции определяется экспериментально или на основании сложных математических расчётов.
Основным понятием в химической кинетике является, понятие о скорости реакции.
Одни реакции протекают практически мгновенно (например, нейтрализация кислоты основанием), другие при обычных условиях идут настолько медленно, что заметные изменения концентраций реагентов наблюдаются лишь через несколько лет (например, взаимодействие водорода с кислородом с образованием воды в отсутствие катализатора). При этом существует множество реакций, протекающих с вполне измеримыми скоростями в обычных условиях. Химическая кинетика занимается определением скоростей химических реакций и изучением их механизма.
Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени (вступившего в реакцию или образовавшегося в результате реакции) в единице объема системы (для гомогенной р-и) или на единице площади поверхности раздела фаз (для гетерогенной реакции).
 С(концентрация)
С(концентрация)
 |

t (время)
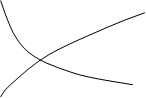
Рисунок 1. - График зависимости концентрации от времени.
Где 1-изменение концентрации исходного вещества;
2- изменение концентрации продукта реакции
Из этого графика следует, что при химическом взаимодействии концентрация каждого из исходных веществ уменьшается во времени (С2<C1;  C<0), а концентрация продуктов реакции увеличивается (C2>C1,
C<0), а концентрация продуктов реакции увеличивается (C2>C1, 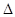 С>0).
С>0).
В химической кинетике различают среднюю и истинную (мгновенную) скорость.
Средняя скорость.
Если при неизменных объеме и температуре концентрация одного из реагирующих веществ уменьшилась от С1 до С2 за промежуток времени от t1 до t2, то в соответствии с определением средняя скорость прямой реакции за данный промежуток времени равна
u = - 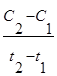 .
.
Знак “-” в правой части уравнения появляется, т. к. по мере протекания реакции (t2-t1 > 0) концентрация реагентов убывает, следовательно, С2-С1 < О, а так как ско-рость реакции всегда положительна, то перед дробью следует поставить знак “-”. Если речь идёт о скорости как прямой, так и обратной реакции, то эта формула имеет вид: u = 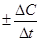 .
. 
Истинная скорость.
Истинная скорость реакции определяется пределом, к которому стремится отношение 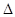 С/
С/ 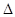 t при
t при 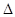 t®0, т. е. производной концентрации по времени:
t®0, т. е. производной концентрации по времени:
u =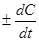 .
.
Обычно для реакций, протекающих в газах или растворах, концентрации реагентов выражают в моль/л, а скорость реакции — в моль/(л* с).
Реакции происходят при столкновении молекул реагирующих веществ. Ее скорость определяется количеством столкновений и вероятностью того, что они приведут к превращению. Число столкновений определяется концентрациями реагирующих веществ, а вероятность реакции - энергией сталкивающихся молекул.
Факторы, влияющие на скорость химических реакций
Природа реагирующих веществ. Большую роль играет характер химических связей и строение молекул реагентов. Реакции протекают в направлении разрушения менее прочных связей и образования веществ с более прочными связями. Так, для разрыва связей в молекулах H2 и N2 требуются высокие энергии; такие молекулы мало реакционноспособны. Для разрыва связей в сильнополярных молекулах (HCl, H2O) требуется меньше энергии, и скорость реакции значительно выше. Реакции между ионами в растворах электролитов протекают практически мгновенно.
Пример
Фтор с водородом реагирует со взрывом при комнатной температуре, бром с водородом взаимодействует медленно и при нагревании. Оксид кальция вступает в реакцию с водой энергично, с выделением тепла; оксид меди - не реагирует.
Концентрация. С увеличением концентрации (числа частиц в единице объема) чаще происходят столкновения молекул реагирующих веществ - скорость реакции возрастает.
