Оксиды углерода
Оксид углерода (II) (угарный газ) – бесцветный газ, без запахаи вкуса плохо растворим в воде. Температура плавления –205 0С. температура кипения –191°С, относительная молекулярная масса СО равна 28, поэтому он мало отличается по плотности от воздуха. Угарный газ – ядовитое вещество. Отравление в легкой форме сопровождается головокружением, головной болью и рвотой. Сильное отравление приводит к смерти. Отравляющее действие СО объясняется тем, что он образует более прочное,чем кислород, соединение с гемоглобином. В связи с этим нарушается перенос кислорода от легких к тканям.
Формальная степень окисления углерода +2 не отражает строение молекулы СО. В молекуле СО, помимо двойной связи, образованной обобществлением электронов углерода и кислорода, имеется дополнительная, третья связь (изображена стрелкой), образованная по донорно-акцепторному механизму за счет неподеленной пары электронов кислорода: 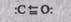
В связи с этим молекула СО прочна. Оксид углерода (II) является несолеобразующим и не взаимодействует в обычных условиях с водой, кислотами и щелочами. При повышенных температурах он склонен к реакциям присоединения и окисления – восстановления. На воздухе СО горит синим пламенем: 2СО + О2 = 2СО2
Он восстанавливает металлы из их оксидов и солей:
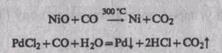
Под действием облучения (на прямом солнечном свету) или в присутствии катализаторов СО соединяется с С12, образуя фосген – крайне ядовитый газ: 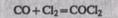
Со многими металлами СО под давлением образует летучие карбонилы:
Ni + 4CO = Ni(CO)4
Fe + 5CO = Fe(CO)5
Ковалентная связь Me–С в молекуле карбонила образуется по донорно-акцепторному механизму. При нагревании карбонилы металлов разлагаются на металл и оксид углерода (II), что используется для получения металлов особой чистоты.
В природе оксид углерода (II) практически не встречается. Он может образовываться при обезвоживании муравьиной кислоты (лабораторный способ получения):
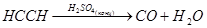
Исходя из последнего превращения, чисто формально можно считать СО ангидридом муравьиной кислоты. Это подтверждается следующей реакцией, которая происходит при пропускании СО в расплав щелочи при высоком давлении: CO + NaOH = HCOONa
Оксид углерода (IV) (диоксид углерода, углекислый газ) – газ без цвета и запаха, на вкус слегка кисловатый, не поддерживающий дыхания и горения. Он хорошо растворим в воде (88 объемов СО2 в 100 объемах Н2О при 293 К). При обычной температуре под давлением 60 атм. диоксид углерода переходит в жидкость. При охлаждении до –76 °С оксид углерода (IV) превращается в твердую белую массу, называемую сухим льдом. Твердая двуокись углерода переходит в газообразное состояние (сублимирует), минуя жидкое.
Относительная молекулярная масса диоксида углерода равна 44, поэтому он в 1,52 раза тяжелее воздуха.
При большой концентрации оксида углерода (IV) в воздухе люди и животные задыхаются. При содержании в воздухе 3% у человека наблюдается учащенное дыхание, 10% – потеря сознания и смерть, при 20% – мгновенный паралич.
Оксид углерода (IV) как кислотный оксид взаимодействует с основными оксидами и щелочами: K2O + CO2 = K2CO3
2NaOH + CO2 = Na2CO3 + H2O
При растворении в воде диоксид углерода взаимодействует с ней (менее 1% от растворенного количества) с образованием крайне слабой и непрочной угольной кислоты:
CO2 + H2O 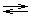 H2CO3
H2CO3
О ее слабости говорит и тот факт, что из соединений она вытесняется даже уксусной кислотой: CaCO3 + 2CH3COOH = Ca(CH3COO)2 + H2O + CO2
Углекислый газ способен выступать окислителем; при нагревании с углеродом образуется угарный газ: C + CO2 = 2CO
Зажженная на воздухе лента металлического магния продолжает гореть в атмосфереСО2
2Mg + CO2 = 2MgO + C
Оксид углерода (IV), нагретый до 350 – 400°С, над никелем восстанавливает водородом до метана: CO2 + 4H2 = CH4 + 2H2O
Оксид углерода (IV) получают термическим разложением солей угольной кислоты или действием на них растворов более сильных кислот: CaCO3 = CaO + CO2
NaCO3 + H2SO4 = Na2SO4 + H2O + CO2
