Количественное определение белка биуретовым методом. Построение калибровочных кривых
Определение концентрации белка проводят в научных учреждениях при изучении, выделении и очистке белков; в промышленности в процессе получения ферментов, пищевых белков, белковых лекарственных препаратов; в медицинских биохимических лабораториях для оценки состояния печени и почек.
Существует много разных методов количественного определения белков. Среди них широкое распространение получили колориметрические методы, основанные на способности белков давать окрашенные комплексы с рядом реактивов (цветные реакции). Среди этих методов наиболее распространены биуретовый метод и его модификация (метод Лоури[‡]).
Цель работы
Освоить работу фотоэлектроколориметра (ФЭК). Научиться строить стандартные калибровочные кривые. Определить содержание белка в пробе с неизвестной концентрацией.
Принцип метода
Биуретовый метод основан на образовании окрашенного в фиолетовый цвет комплекса пептидных связей белка с ионами двухвалентной меди в щелочной среде (биуретовая реакция). Интенсивность развивающейся окраски раствора прямо пропорциональна концентрации белка и определяется фотометрически. Для количественного определения белка измеряют интенсивность окраски стандартных растворов белка с известной концентрацией (величину оптической плотности Dст). По полученным данным строят график зависимости оптической плотности окрашенных растворов от концентрации в них белка (стандартную калибровочную кривую). На оси ординат всегда откладывают величину D как функцию от задаваемых значений (см. рисунок).
Измеряют оптическую плотность Dх окрашенного раствора с неизвестной концентрацией белка и по стандартной кривой определяют в нем концентрацию белка. В качестве стандартного белка обычно используют раствор сывороточного альбумина.
Выполнение работы
| Реактивы, мл | Контроль | Стандартный белок 10 мг/мл | Стандартный белок 20 мг/мл | Стандартный белок 30 мг/мл | Неизвестный белок Х мг/мл | ||
| Раствор сывороточного альбумина, мл | — | 0,2 | 0,2 | 0,2 | 0,2 | ||
| Н2О, мл | 0,2 | — | — | — | — | ||
| Биуретовый реактив*, мл | |||||||
| Перемешивают и инкубируют 30 минут при комнатной температуре | |||||||
| Фотометрируют против Н2О (l = 545 нм, толщина кюветы 1 см). D545 | |||||||
| Dст – Dк; Dх – Dк | |||||||
*Биуретовый реактив: исходный концентрат (медь сернокислая – 120 ммоль/л, калий иодистый – 300 ммоль/л, калий-натрий виннокислый – 320 ммоль/л, гидроксид натрия –3 моль/л) разводят перед работой 1:19
 Оформление работы
Оформление работы
В рабочей тетради записать и заполнить таблицу; построить стандартную кривую и определить по ней концентрацию белка в неизвестном растворе.
Выводы
 Тестовые задания по теме: «Аминокислоты и простые белки»
Тестовые задания по теме: «Аминокислоты и простые белки»
1) Ответить на каждый вопрос однозначно: «да» или «нет»
1. Имидазольное кольцо гистидина содержит 1 атом азота.
2. N-концевая аминокислота в дипептиде гистидиллизин - гистидин.
3. С-концевая аминокислота в трипептиде серилпролилглицин - глицин.
4. Альбумины сыворотки крови выполняют транспортную функцию.
5. Пролин содержит имино-группу.
6. Аспарагиновая кислота является производным янтарной кислоты.
7. Все ли пептиды дают положительную биуретовую реакцию?
8. Зависит ли интенсивность окраски вещества в растворе от его концентрации?
9. Можно ли разделить белки методом высаливания, используя сернокислую медь (сульфат меди)?
10. Встречаются ли в организме человека аминокислоты, которые не входят в состав белков?
11. Участвует ли ε-NH2-группа лизина в образовании пептидной связи в белках?
12. Обладают ли радикалы серина и валина гидрофильными свойствами?
2) Выбрать один правильный ответ
| Аминокислота с незаряженным радикалом: треонин лизин аргинин гистидин глутаминовая кислота | Для определения оптической плотности синего раствора используют светофильтр: голубой желтый красный зеленый синий |
3) Найти соответствие
| АМК | Химическая группа в составе радикалов |
| метионин серин аргинин цистеин аспарагин | А. гидроксильная Б. амидная В. тиометильная Г. гуанидиловая Д. сульфгидрильная |
 1.4. Диализ белков. Бумажная хроматография аминокислот
1.4. Диализ белков. Бумажная хроматография аминокислот
I. А. Диализ
Диализом называют процесс разделения высокомолекулярных веществ (например, белков) и низкомолекулярных (например, солей) с помощью полупроницаемых мембран.
Полупроницаемыми называют мембраны, диаметр пор которых позволяет проходить только низкомолекулярным соединениям. Примером естественных полупроницаемых мембран могут быть капсулы Боумена—Шумлянского почек. Широко используют искусственные полупроницаемые мембраны: целлофан, коллодий, на основе которых созданы диализаторы, в том числе «искусственная почка».
Метод диализа используют в научных лабораториях, в промышленности, в клинической практике.
Цель работы
Доказать, что низкомолекулярное соединение NaCl проходит через полупроницаемую мембрану, а высокомолекулярный белок не проходит и остается в диализируемом растворе.
Принцип метода
Метод основан на том, что низкомолекулярные вещества легко диффундируют через полупроницаемые мембраны в чистый растворитель, образуя диализат. Диффузия будет продолжаться, пока не произойдет выравнивание концентраций диффундируемого вещества между диализируемым раствором и диализатом. Процесс возобновится, если диализат заменить чистым растворителем или, если эта смена будет происходить постоянно (проточный диализ).
Выполнение работы
Подготовка диализатора: полупроницаемой мембраной могут быть диализные трубки или целлофановые диализные мешочки. Целлофан (квадрат 10х10 см) смачивают дистиллированной водой, делают в нем углубление и получают диализный мешочек.
Приготовление диализируемого раствора: в диализный мешочек помещают 20 капель разведенного яичного белка в 5 % растворе NaCl (белок одного яйца разводят в 300 мл 5% раствора NaCl) и перемешивают. Края целлофана зажимают между двумя стеклянными палочками, скрепленными между собой резиновыми кольцами.
Диализ. Мешочек с солевым раствором белка помещают в стакан с дистиллированной водой так, чтобы часть мешочка с раствором белка была полностью погружена в воду. Сразу же, на просвет можно заметить струйки солевого раствора, опускающиеся из мешочка на дно стакана, что обусловлено изменением рефракции воды.
Анализ результатов диализа. Через 60 мин после начала диализа проводят качественные пробы на белок (биуретовую реакцию) и на NaCl (с AgNO3) в соответствии с таблицей.
| Реактивы | Проба на белок в диализате | Проба на белок в диализируемой жидкости | Проба на ионы Cl- в диализате |
| Диализат | 10 капель | – | 10 капель |
| Диализируемый раствор | – | 10 капель | – |
| 10 % NaOH | 5 капель | 5 капель | – |
| 1 % CuSO4 | 1 капля | 1 капля | – |
| 10 % HNO3 | – | – | 1 капля |
| 1 % AgNO3 | – | – | 1 капля |
| Наблюдения |
Выводы
Б. Хроматография аминокислот
Хроматографический метод, разработанный русским ученым М.С. Цветом, является одним из относительно простых и быстрых методов разделения смеси веществ.
Существует несколько разновидностей метода в зависимости от принципа разделения смеси на составляющие компоненты (адсорбционная, ионообменная, аффинная хроматография).
Примером адсорбционной хроматографии является распределительная хроматография на бумаге, которая оказалась наиболее доступной для разделения аминокислот, отличающихся гидрофобностью радикалов а также для идентификации неизвестных аминокислот путём сравнения их подвижности со стандартными растворами известных аминокислот.
Цель работы
Провести разделение смеси двух неизвестных аминокислот[§], рассчитать для каждой из них Rf (см. далее) и идентифицировать аминокислоты по сравнению с Rf стандартов (глутаминовая кислота и лейцин).
Принцип метода
Метод основан на различной растворимости отдельных аминокислот в двух частично смешивающихся жидкостях: в воде, которая удерживается фильтровальной бумагой и является неподвижной фазой растворителя, и в подвижной фазе органического растворителя (бутанол : уксусная кислота : вода, 5 : 1 : 4).
По мере продвижения растворителя по бумаге происходит многократное перераспределение аминокислот между подвижной и неподвижной фазами растворителей. Чем больше гидрофобность аминокислоты, тем быстрее она будет продвигаться по бумаге и наоборот. В соответствии с этим расстояния, которые аминокислоты пройдут с подвижной фазой растворителя по бумаге, будут различными.
Скорость передвижения каждой аминокислоты может быть выражена коэффициентом распределения (Rf). Коэффициентом распределения называют отношение расстояний (в мм) от места нанесения аминокислоты (старта) до середины ее пятна (величина а) к расстоянию от места старта до границы фронта растворителя (величина b). Чем выше гидрофобность аминокислотного радикала, тем ближе к единице будет величина Rf.
Коэффициент распределения для каждой аминокислоты постоянен при стандартных условиях проведения опыта (тип бумаги, температура, тип растворителя, влажность) и служит средством идентификации аминокислот по сравнению со стандартами.
Выполнение работы
Диск хроматографической бумаги (d = 12 см) размечают карандашом (см. рисунок ниже).
В места, отмеченные точками, наносят по 2 мкл образцов стандартных растворов аминокислот (0,6% раствор глутаминовой кислоты и 0,5% раствор лейцина) и смесь неизвестных аминокислот. Высушивают бумажный диск с образцами на воздухе.
Разрезают хроматографический диск по линиям разреза, отгибают по линии сгиба получившуюся ножку и укорачивают ее до длины 3 см. Помещают диск в хроматографическую камеру (чашку Петри) так, чтобы ножка была погружена в органический растворитель.
Когда фронт растворителя пройдет 5 - 6 см, извлекают хроматограмму из камеры и тщательно обводят карандашом образовавшийся фронт растворителя.
Высушивают диск в сушильном шкафу при 60-80°С.
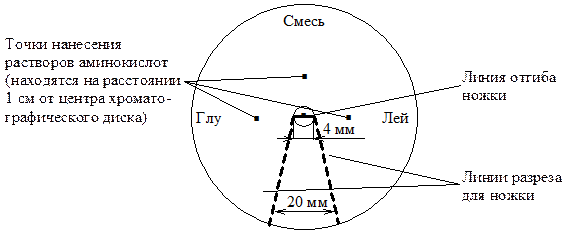
Погружают диск в 0,5% раствор нингидрина в ацетоне и вновь высушивают до проявления пятен аминокислот[**].
Оформление работы:
В рабочей тетради записать ход работы, рассчитать значение Rf для каждой аминокислоты, вклеить полученную хроматограмму или зарисовать её.
Выводы
Тестовые задания по теме: «Структура и свойства пептидов и белков»
1) Ответить на каждый вопрос однозначно: «да» или «нет»
1. Целостность четвертичной структуры белка важна для проявления его биологической активности.
2. Кератин не растворим в воде.
3. Все белки содержат однотипные домены.
4. Фолдинг белковых молекул начинается с быстрого формирования элементов вторичной структуры.
5. Природные пептиды могут обладать гормональной активностью.
6. Применим ли метод диализа для разделения белков с различной молекулярной массой?
7. Существуют ли белки, не содержащие β-складчатые слои?
8. Можно ли разделить белки методом бумажной хроматографии?
9. Вся ли полипептидная цепь белков полностью спирализована?
10. Содержится ли белок в моче здорового человека?
11. Участвуют ли водородные связи в образовании вторичной структуры белка?
12. Относятся ли гистоны к кислым белкам?
2) Выбрать один правильный ответ
| Смесь различных белков невозможно разделить методом: ионнообменной хроматографии электрофореза высаливания диализа гель-фильтрации | Шапероны участвуют в образовании: первичной структуры белков первичной структуры нуклеиновых кислот третичной структуры белков третичной структуры нуклеиновых кислот вторичной структуры нуклеиновых кислот |
3) Найти соответствие
| Характер радикала аминокислот | АМК |
| Гидрофильный Гидрофобный Амфифильный | А. Лейцин Б. Глицин В. Валин Г. Серин Д. Глутамин |
1.5. Коллоквиум I по теме «Аминокислоты и простые белки»
Вопросы, для самостоятельной подготовки
1. Классификация белков. Химия простых белков. Природные пептиды.
2. Аминокислотный состав белков. Цветные реакции на белки.
3. Физико-химические свойства белков. Изоэлектрическая точка растворов белков.
4. Уровни структурной организации белков: первичная, вторичная третичная и четвертичная структуры белков. Связь структуры белка с биологической функцией.
5. Аминокислоты: их строение и свойства. Классификация аминокислот. Характер связи аминокислотных остатков в молекуле белка.
6. Доменная структура белков. Фолдинг белковых молекул. Понятие о шаперонах.
7. Биологически активные пептиды
Варианты письменной части коллоквиума
| 1. Написать формулу трипептида. глутамилпролиллизин I. аспартиллизилпролин II. пролиларгинилглутамат III. гистидиллизилсерин 2. Какими методами можно разделить: I. альбумины и глобулины? II. казеин и продукты его гидролиза? III. гис и гли? IV. асп и арг? 3. Как можно определить наличие в растворе: I. трп? II. мет? III. глобулинов? IV. цис? | 4. Привести один пример белка из группы: I. протаминов II. проламинов III. альбуминов IV. глобулинов 5. Охарактеризовать структуру белка: I. первичную II. вторичную III. третичную IV. четвертичную 6.Дать краткое определение понятия: I. пострансляционная модификация белка II. фолдинг белковых молекул III. олигомерные белки IV. шапероны |
Варианты заданий на компьютерном тестировании
Инструкция к тесту: выбрать все правильные ответы
| 1. Незаменимые для человека аминокислоты 1. фенилаланин 2. тирозин 3. триптофан 4. треонин 5. метионин 2. Положительным зарядом в радикальной части обладают аминокислоты 1. аспарагин 2. глутамин 3. лизин 4. глутамат 5. гистидин 3. Серосодержащие аминокислоты метионин 1. лизин 2. валин 3. цистеин 4. аргинин 4. Гидрофобные аминокислоты 1. глутамин 2. валин 3. треонин 4. фенилаланин 5. изолейцин 5. При денатурации белка не нарушаются связи 1. дисульфидные 2. водородные 3. пептидные 4. ионные 5. гидрофобные 6. Донор метильных групп 1. валин 2. лейцин 3. метионин 4. аргинин 5. треонин 7. Наибольшая величина Rf при бумажной хроматографии будет для аминокислоты 1. глицина 2. треонина 3. серина 4. глутамата 5. валина 8. Изоэлектрическая точка белка зависит от 1. наличия гидратной оболочки 2. суммарного заряда аминокислотных радикалов 3. наличия водородных связей 4. наличия спиральных участков в молекуле 5. всех перечисленных параметров 9. Биуретовая реакция будет положительной для 1. простых белков 2. дипептидов 3. трипептидов 4. раствора аминокислот 5. желатины 10. Олигомерные белки проходят через полупроницаемую мембрану 1. не содержат a-спиральных участков 2. состоят из нескольких полипептидных цепей 3. не обладают четвертичной структурой 4. соответствуют всем вышеуказанным утверждениям 11. Гидрофильные аминокислоты 1. глутамин 2. серин 3. аргинин 4. фенилаланин 5. аспарагин 12. Аминокислота без стереоизомеров 1. тирозин 2. глицин 3. аланин 4. цистеин 5. серин 13. Незаменимые для человека аминокислоты 1. лизин 2. треонин 3. орнитин 4. валин 5. цистеин 14. Аминокислоты с незаряженными радикалами 1. треонин 2. триптофан 3. аргинин 4. гистидин 5. серин 15. Аминокислоты – производные пропионовой кислоты 1. аланин 2. серин 3. цистеин 4. треонин 5. фенилаланин 16. Гидрофобная аминокислота 1. серин 2. лейцин 3. глутамин 4. цистеин 5. лизин 17. Денатурацию белка вызывает добавление 1. концентрированной азотной кислоты 2. сульфата меди 3. азотнокислого серебра 4. концентрированной щелочи 5. сульфата аммония 18. Сульфгидрильную группу (тиогруппу) содержит аминокислота 1. аспарагин 2. гистидин 3. лизин 4. цистеин 5. метионин 19. Методом ионообменной хроматографии нельзя разделить 1. глутамат и лизин 2. глутамат и лейцин 3. лейцин и лизин 4. лейцин и валин 5. валин и глутамат 20. Денатурация белка всегда сопровождается 1. нарушением третичной структуры белка 2. гидролизом пептидных связей 3. появлением окраски 4. образованием функциональных комплексов с другими белками 5. потерей нативных биологических свойств 21. Третичную структуру белков стабилизируют связи 1. сложноэфирные 2. гидрофобные 3. водородные 4. ионные 5. дисульфидные 22. Нингидриновая реакция отрицательная с 1. простыми белками 2. дипептидами 3. трипептидами 4. свободными аминокислотами 5. карбоновыми кислотами | 23. Коллаген содержит много остатков 1. гистидина 2. глицина 3. аспарагина 4. лейцина 5. глутамата 24. Незаменимые для человека аминокислоты 1. лейцин 2. аланин 3. фенилаланин 4. пролин 5. аспарагин 25. Производным янтарной кислоты является 1. глутаминовая кислота 2. гистидин 3. пролин 4. триптофан 5. аспарагиновая кислота 26. Молекулярную массу белков можно определить 1. электрофорезом в полиакриламидном геле 2. диализом 3. ионообменной хроматографией 4. колориметрически 5. гель-фильтрацией 27. Альбумины растворимы в 1. дистиллированной воде 2. фосфатном буфере, pH=6,8 3. полунасыщенном растворе сульфата аммония 4. полунасыщенном растворе сульфата меди 5. насыщенном растворе сульфата аммония 28. Смесь белков с различной молекулярной массой можно разделить 1. гель-фильтрацией 2. ультрафильтрацией через фильтры с молекулярным размером пор 3. диализом 4. ультрацентрифугированием 5. высаливанием 29. Положительную ксантопротеиновую реакцию дают 1. фенилаланин 2. метионин 3. триптофан 4. аргинин 5. аспарагин 30. Шапероны участвуют в образовании и поддержании главным образом 1. первичной структуры белков 2. первичной структуры нуклеиновых кислот 3. третичной структуры белков 4. третичной структуры нуклеиновых кислот 5. вторичной структуры нуклеиновых кислот 31. Гидрофильными аминокислотами являются 1. фенилаланин 2. лейцин 3. треонин 4. серин 5. аланин 32. Фолдинг белка – это 1. формирование первичной структуры 2. модификация аминокислотных остатков 3. формирование третичной структуры 4. транспорт в митохондрии 33. Незаменимые для человека аминокислоты 1. изолейцин 2. аланин 3. глицин 4. валин 5. аспарагин 34. Аминокислоты с положительным зарядом в радикале 1. гистидин 2. валин 3. аргинин 4. лизин 5. изолейцин 35. Аминокислота – производное глутаровой кислоты 1. аспарагиновая кислота 2. глутаминовая кислота 3. аргинин 4. лизин 5. гистидин 36. Аминокислоты с отрицательным зарядом в радикале 1. аспарагин 2. глутамин 3. глутамат 4. аргинин 5. аспартат 37. Белки с различной молекулярной массой нельзя разделить, используя 1. трихлоруксусную кислоту 2. гидроксид натрия 3. сульфат меди 4. сульфат аммония 38. Положительно заряженные белки 1. альбумины 2. глобулины 3. глутелины 4. гистоны 5. протамины 39. Сложные белки 1. протамины 2. миоглобин 3. гистоны 4. флавопротеины 5. гемоглобин 40. Для очистки белков от солей используют методы 1. гель-фильтрации 2. диализа 3. бумажной хроматографии 4. гидролиза 5. все вышеперечисленные 41. Положительную реакцию Фоля дает 1. триптофан 2. гистидин 3. тирозин 4. треонин 5. цистеин 42. Наиболее прочные связи в молекуле белка 1. пептидные 2. дисульфидные 3. водородные 4. ионные 5. гидрофобные 43. Олигомерные белки отличаются от других белков наличием 1. неупорядоченной структуры 2. вторичной структуры 3. третичной структуры 4. четвертичной структуры 5. доменного строения |
Правильные ответы
| 1.1, 3, 4, 5 2.3, 5 3.1, 4 4.2, 4, 5 5.3 6.3 7.5 8.2 9.1, 3, 5 10.3 11.1, 2, 3, 5 12.2 13.1, 2, 4 14.1, 2, 5 15.1, 2, 3, 5 | 16.2 17.1, 2, 3, 4 18.4 19.4 20.1, 5 21.2, 3, 4, 5 22.5 23.2 24.1, 3 25.5 26.1, 5 27.1, 2, 3 28.1, 2, 4, 5 29.1, 3 30.3 | 31.3, 4 32.3 33.1, 4 34.1, 3, 4 35.2 36.3, 5 37.1, 2, 3 38.4, 5 39.2, 4, 5 40.1, 2 41.5 42.1 43.4 |
Раздел 2: Сложные белки, нуклеиновые кислоты и ферменты
Введение
Как уже было сказано во введении к разделу 1, сложные (конъюгированные) белки построены из белковой и небелковой части. В качестве небелковой части (простетической группы) сложных белков могут выступать различные химические соединения, что находит отражение в классификации данной группы биологических соединений:
Хромопротеины
Нуклеопротеины
Липопротеины
Фосфопротеины
Гликопротеины
Металлопротеины
Хромопротеины содержат окрашенную простетическую группу, например, красные белки - гемопротеины (гемоглобин, миоглобин, цитохромы, каталаза, пероксидаза), желтые белки - флавопротеины (ферменты класса оксидоредуктаз, содержащие производные рибофлавина).
Нуклеопротеины в качестве простетической группы содержат ДНК или РНК, что объясняет их участие в экспрессии генов и биосинтезе белка.
Липопротеинысодержат такие липиды как триацилглицеролы, свободные жирные кислоты, эфиры холестерина, фосфолипиды и отличаются друг от друга процентным содержанием белка и плотностью. Липопротеины встречаются как в свободном виде (ЛП плазмы крови), так и в структурированном (в составе клеточных и внутриклеточных биомембран).
Фосфопротеины участвуют в процессе эмбриогенеза. Это такие белки как казеиноген молока, вителлин и фосвитин куриного желтка, ихтулин икры рыб. Известно, что фосфорилирование-дефосфорилирование белков и ферментов – способ изменения их функциональной активности.
Гликопротеины являются объектом интенсивного исследования, что объясняется многообразием их строения и выполняемых функций. Это гликоконъюгаты, к котрым относят большинство белковых гормонов, антитела (иммуноглобулины), белки плазмы крови и молока, интерфероны, факторы комплемента, рецепторные белки.
Металлопротеины представляют белки, содержащие в своей структуре ионы металла (железа, меди, кобальта, марганца, молибдена, цинка, магния, кальция и др.). Типичные представители металлопротеинов, содержащих негемовое железо, – это ферритин, трансферрин, гемосидерин.
Нуклеиновые кислоты относят к высокомолекулярным соединениям, состоящим из пуриновых и пиримидиновых оснований, остатков рибозы или дезоксирибозы и фосфорной кислоты. Данный класс соединений выполняет функцию хранения и передачи наследственной информации, а структурные компоненты нуклеиновых кислот (нуклеотиды) входят в состав коферментов (НАД+, ФАД, КоА), являются макроэргическими соединениями (АТФ, УТФ, ЦТФ, ГТФ, ТТФ) и вторичными посредниками (цАМФ, цГМФ) в передаче внутриклеточного сигнала.
Изучение ферментов (энзимов) выделено в отдельную науку – энзимологию. Все ферменты имеют белковую природу, чем объясняются их свойства (термолабильность, зависимость активности от рН среды, высокоспецифичное действие по отношению к реагирущим веществам – субстратам ферментативной реакции). Ферменты являются биокатализаторами, т. е. ускоряют химические реакции (такой способностью обладают ещё только некоторые РНК, которые называют рибозимами). Активность ферментов выражается в каталах (количество фермента, которое превращает 1 моль субстрата за 1 с), а также в международных единицах (Е) (количество фермента, превращающего 1 мкмоль субстрата за 1мин). Все изученные ферменты включены в особый каталог (классификация ферментов – КФ) и имеют свой классификационный номер, в котором первая цифра указывает на принадлежность к одному из 6 классов ферментов:
1) оксидоредуктазы
2) трансферазы
3) гидролазы
4) лиазы
5) изомеразы
6) лигазы (синтетазы)
Лабораторный практикум в рамках этой темы охватывает изучение влияния температуры на активность фермента и скорость химической реакции (на примере амилазы), а также изучение специфических фермент-субстратных отношений (амилаза – крахмал; щелочная фосфатаза - п-нитрофенилфосфат).
