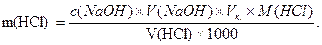Класифікація потенціометричних методів аналізу
Метод прямої потенціометрії (йонометрії) заснований на визначенні концентрації досліджуваного йону за величиною ЕРС електрохімічного ланцюга з індикаторним електродом, селективним до цього йону.
Для визначення концентрацій за виміряною величиною ЕРС в йонометрії найбільш часто використовують два методи: метод градуювального графіку та метод добавок.
Потенціометричне титрування засноване на індикації точки еквівалентності за зміною ЕРС потенціометричної комірки в ході титрування. Найбільш часто використовують наступні види кривих титрування:
· інтегральна крива титрування;
· диференційна крива тирування;
· крива Грана.
Потенціометричне титрування дозволяє проводити визначення в непрозорих та забарвлених розчинах. Шляхом підбору титрантів можливе визначення речовин, для яких в цей час відсутні йонселективні електроди. Точність його вища, ніж йонометрії.
Експериментальна частина
Завдання 1. Визначення рН природної води
Прилади і реактиви:
1.рН-метр-мілівольтметр рН-121.
2.Хлорсрібний електрод порівняння.
3.Скляний електрод з водневою функцією.
4.Стакан місткістю 50 або 100 см3.
5.Стандартні буферні розчини з різним значенням рН.
Виконання роботи
Перед початком роботи скляний електрод витримують у воді або слабкому розчині кислоти.
Налаштування приладу за буферними розчинами проводять в наступному порядку: наливають в стакан один з буферних розчинів (наприклад, з рН = 4,01), опускають в нього електроди і підключають їх до приладу. Включають прилад на відповідний діапазон вимірювання рН. Перевіряють налаштування приладу за іншими буферними розчинами. При відхиленні показів приладу від значення рН розчину більш, ніж на ±0,5 рН (в діапазоні 1-14), необхідно провести корекцію.
При кожному занесенні електродів у буферний розчин їх добре промивають дистильованою водою, видаляють надлишок води з них фільтрувальним папером. Відрахунок рН за шкалою приладу беруть через 0,5-1 хвилину.
У стакан наливають пробу води, в якій треба визначити рН. Електроди промивають дистильованою водою, надлишок води видаляють фільтрувальним папером. Заносять електроди в досліджуваний розчин і виміряють значення рН.
Розраховують концентрацію водневих і гідроксильних йонів (в моль/дм3): [H+] = 10-pH; [OH-] = 10pH-pKw.
Завдання 2. Визначення вмісту хлоридної кислоти
Прилади і реактиви:
1.рН-метр-мілівольтметр рН-121.
2.Хлорсрібний електрод порівняння.
3.Скляний електрод з водневою функцією.
4.Стакан для титрування місткістю 100 см3.
5.Стандартний розчин HCl, 0,1 моль/дм3 (готують з фіксаналу).
6.Мірна колба місткістю 100 см3.
7.Розчин NaOH, 0,1 моль/дм3.
8.Досліджуваний розчин HCl.
Виконання роботи
1.Підготовка до роботи скляного електроду і настроювання приладу за буферними розчинами – див. Завдання 1.
2.Встановлення точної концентрації робочого розчину натрію гідроксиду. У стакан для титрування піпеткою вводять 10 см3 стандартного розчину HCl, додають стільки дистильованої води, щоб повністю накрити робочу поверхню електродів. Включають магнітну мішалку.
Бюретку заповнюють титрантом. Титрування проводять у вузькому діапазоні рН, спочатку “1-4”, потім, по мірі титрування “4-9” і т.д. При цьому після додавання кожної порції титранту вимірюють рН розчину. Титрант додають по 0,5 см3 на початковій дільниці кривої титрування і по 0,1-0,2 см3 в області скачка титрування. Проводять не менше трьох титрувань.
За отриманими даними будують криву титрування рН = f(V), за якою встановлюють кінцеву точку титрування. Беруть середнє значення об’єму титранту і розраховують концентрацію натрію гідроксиду за формулою:
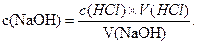
3.Аналізований розчин хлоридної кислоти в мірній колбі місткістю 100 см3, розбавляють до мітки дистильованою водою і добре перемішують. Переносять 10 см3 цього розчину в стакан для титрування. Додають дистильовану воду до повного покриття електродів і проводять титрування не менше трьох разів. За результатами титрування будують криву потенціометричного титрування. Вираховують середнє значення об’єму титранту.
Вміст хлоридної кислоти в досліджуваному розчині розраховують за формулою: