Количественные характеристики дс
ХИМИЯ
ЛАНЬ
САНКТ-ПЕТЕРБУРГ • МОСКВА • КРАСНОДАР
ПРЕДИСЛОВИЕ
Уважаемые студенты!
Коллоидная химия занимает важное место в системе подготовки специалистов для различных областей промышленности. Курс коллоидной химии завершает общехимическую подготовку будущих специалистов и предшествует изучению специальных технологических дисциплин.
Значение коллоидной химии для технологии обусловлено тем, что будучи наукой о поверхностных явлениях и физико–химических свойствах дисперсных систем, она является химией реальных тел, так как в любой отрасли промышленности есть вещества, находящиеся в раздробленном состоянии. При производстве пластических масс и синтетических волокон, строительных материалов и продуктов питания, красителей и лекарств, в других областях промышленности возникают многочисленные коллоидно–химические проблемы.
Учебник состоит из четырех частей.
Часть 1 знакомит вас с дисперсными системами, являющимися основными объектами, изучаемыми коллоидной химией, и их основной особенностью – наличием большой межфазной поверхности и, как следствие, избытка поверхностной энергии. В главах 2–5 подробно рассмотрены различные виды адсорбции – самопроизвольных процессов в поверхностном слое. Этот материал важен не только вследствие большого практического значения адсорбционных процессов, но и для понимания вопросов устойчивости дисперсных систем, методов их получения и разрушения. В конце первой части описаны такие самопроизвольные поверхностные явления, как смачивание и адгезия, играющие важную Роль в различных областях человеческой деятельности.
Часть 2 посвящена описанию коллоидного состояния вещества. Содержание глав 6–10 составляют методы получения и очистки коллоидных растворов, их основные свойства: оптические, электрические, молекулярно–кинетические, вопросы их кинетической и агрегативной устойчивости. Завершается вторая часть учебника описанием структурно–механических свойств дисперсных систем (глава 11).
В части 3 рассматриваются дисперсные системы, свойства которых принципиально отличаются от свойств лиофобных золей. Это отличие состоит в том, что лиофильные коллоидные растворы образуются самопроизвольно и являются термодинамически устойчивыми и обратимыми. Наиболее типичные представители таких систем – растворы коллоидных поверхностно-активных веществ (глава 12) и высокомолекулярных соединений (главы 13, 14). Лиофильные коллоиды находят широкое применение в различных отраслях промышленности и, вместе с тем, используются в качестве стабилизаторов лиофобных золей и микрогетерогенных систем.
Значительный интерес представляют микрогетерогенные системы, которым посвящена четвертая часть учебника. Суспензии, эмульсии, пены, аэрозоли, порошки повсеместно распространены в природе, встречаются в различных технологических процессах, с ними связаны сложнейшие экологические проблемы, но в большинстве учебников коллоидной химии им уделяется незаслуженно мало внимания. В главах 15–19 последовательно описываются:
а) системы с жидкой дисперсионной средой:
б) суспензии и пасты (дисперсная фаза твердая);
в) эмульсии (дисперсная фаза жидкая);
г) газовые эмульсии и пены (дисперсная фаза газообразная);
д) системы с газовой дисперсионной средой:
е) аэрозоли (дисперсная фаза твердая или жидкая);
и) порошки (дисперсная фаза твердая).
Каждая глава в учебнике заканчивается кратким заключением. Ознакомившись с ним, вы сможете сосредоточиться на основных положениях и выводах, следующих из данной главы. После этого ответьте на вопросы для самоконтроля и посмотрите перечень знаний, которые вы должны были получить.
Надеемся, что предлагаемый учебник окажется вам полезным при изучении специальных технологических дисциплин и в будущей профессиональной деятельности.
ЧАСТЬ ПЕРВАЯ
ДИСПЕРСНЫЕ СИСТЕМЫ.
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
ГЛАВА 1
ДИСПЕРСНЫЕ СИСТЕМЫ
ПРЕДМЕТ КОЛЛОИДНОЙ ХИМИИ
Коллоидная химия занимается изучением дисперсных систем.
Дисперсная система (ДС) – это система, в которой хотя бы одно вещество находится в раздробленном состоянии.
ДС имеет два характерных признака: гетерогенность и дисперсность. Гетерогенность означает, что система состоит как минимум из двух фаз. Казалось бы, в этом нет ничего особенного, ведь с такими системами мы уже встречались при изучении фазовых равновесий или электродных процессов.
Особенность ДС состоит в их дисперсности – одна из фаз обязательно должна быть раздробленной, ее называют дисперсной фазой. Сплошная среда, в которой раздроблена дисперсная фаза, называется дисперсионной средой.
Фаза считается дисперсной, если вещество раздроблено хотя бы в одном направлении. Если вещество раздроблено только по высоте, образуются пленки (ткани, пластины и т. д.). Если вещество раздроблено и по высоте и по ширине, образуются волокна, нити, капилляры. Наконец, если вещество раздроблено по всем трем направлениям, дисперсная фаза состоит из дискретных частиц.
Характерным свойством ДС является наличие большой межфазной поверхности. В связи с этим определяющими являются свойства поверхности, а не частиц в целом. Характерными являются процессы, протекающие на поверхности, а не внутри фазы.
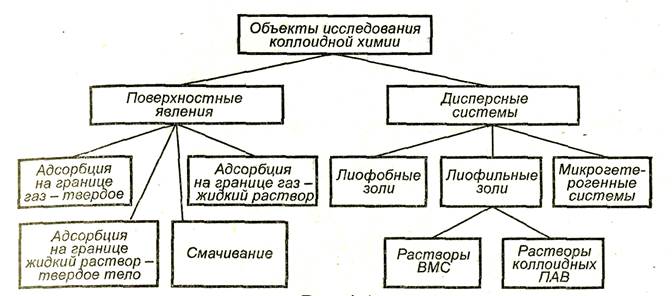
Рис. 1.1 Содержание курса коллоидной химии
Коллоидная химия – это наука о поверхностных явлениях и физико-химических свойствах дисперсных систем (рис. 1.1).
КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ ДС
Для характеристики ДС используются три величины:
1. Поперечный размер частиц – d. [d] = см; м. Для сферических частиц это диаметр сферы, для кубических частиц – ребро куба.
2. Дисперсность (раздробленность) – Д – величина,обратная поперечному размеру частиц:
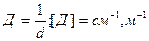
3. Удельная поверхность Sуд – это межфазная поверхность (S1;2), приходящаяся на единицу объема дисперсной фазы (V) или ее массы (m).
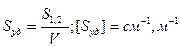
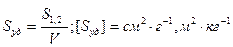
Для сферической частицы с радиусом r:
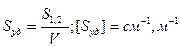
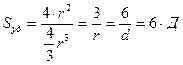
Для кубической частицы с ребром куба d:
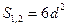 ,
, 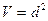
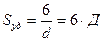 (1.1)
(1.1)
В общем случае
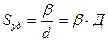
где 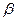 – коэффициент формы частиц (для сферических и кубических частиц
– коэффициент формы частиц (для сферических и кубических частиц 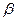 =6)
=6)
КЛАССИФИКАЦИЯ ДС
Классификация ДС может быть проведена на основе различных свойств.
КЛАССИФИКАЦИЯ ПО ДИСПЕРСНОСТИ
Зависимость величины удельной поверхности от дисперсности Sуд = f(d) (см. уравнение 1.1) графически выражается равносторонней гиперболой (рис. 1.2).
Из графика видно, что с уменьшением поперечных размеров частиц величина удельной поверхности существенно возрастает. Если кубик с размером ребра 1 см измельчить до кубических частиц с размерами d = 10-6 см, величина общей межфазной поверхности возрастет с 6 см2 до 600 м2.
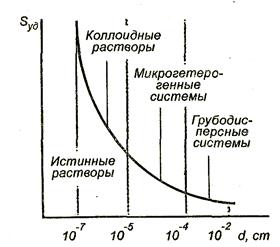 |
Рис.1.2. Зависимость величины удельной поверхности от размеров частиц
При d 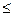 10-7 см гипербола обрывается, так как частицы уменьшаются до размеров отдельных молекул, и гетерогенная система становится гомогенной, в которой межфазная поверхность отсутствует. По степени дисперсности ДС делятся на:
10-7 см гипербола обрывается, так как частицы уменьшаются до размеров отдельных молекул, и гетерогенная система становится гомогенной, в которой межфазная поверхность отсутствует. По степени дисперсности ДС делятся на:
1. грубодисперсные системы, d 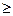 10 -3 см;
10 -3 см;
2. микрогетерогенные системы, 10-5 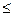 d
d 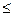 10-3 см;
10-3 см;
3. коллоидно - дисперсные системы или коллоидные растворы, 10-7 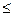 d
d 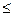 10-5 см;
10-5 см;
4. истинные растворы, d 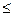 3 10-7 см.
3 10-7 см.
Необходимо подчеркнуть, что самую большую удельную поверхность имеют частицы дисперсной фазы в коллоидных растворах.
КЛАССИФИКАЦИЯ ПО АГРЕГАТНОМУ СОСТОЯНИЮ ФАЗ
Классификация по агрегатному состоянию фаз была предложена Вольфгангом Оствальдом. В принципе возможно 9 комбинаций. Представим их в виде таблицы (см. таблицу 1.1).
КЛАССИФИКАЦИЯ ПО ВЗАИМОДЕЙСТВИЮДИСПЕРСНОЙ ФАЗЫ И ДИСПЕРСИОННОЙ СРЕДЫ(ПО МЕЖФАЗНОМУ ВЗАИМОДЕЙСТВИЮ)
Эта классификация пригодна только для систем с жидкой дисперсионной средой. Г. Фрейндлих предложил подразделить ДС на два вида:
1) лиофобные, в них дисперсная фаза не способна взаимодействовать с дисперсионной средой, а следовательно, и растворяться в ней, к ним относятся коллоидные растворы, микрогетерогенные системы;
2) лиофилъные, в них дисперсная фаза взаимодействует с дисперсионной средой и при определенных условиях способна в ней растворяться, к ним относятся растворы коллоидных ПАВ и растворы ВМС.
Таблица 1.1
Классификация по агрегатному состоянию фаз
| Агрегатное состояние дисперсной фазы | Агрегатное состояние дисперсной среды | Условное обозначение ф/с | Название системы | Примеры |
| г | г | г/г | аэрозоли | атмосфера Земли |
| ж | г | ж/г | туман, слоистые облака | |
| тв | г | тв/г | дымы, пыли, перистые облака | |
| г | ж | г/ж | газовые эмульсии, пены | газированная вода, мыльная пена, лечебный кислородный коктейль, пивная пена |
| ж | ж | ж/ж | эмульсии | молоко, масло сливочное, маргарин, кремы и т.д. |
| тв | ж | тв/ж | лиозоли, суспензии | лиофобные коллоидные растворы, суспензии, пасты, краски и т.д. |
| г | тв | г/тв | твердые пены | пемза, твердые пены, пенопласт, активированный уголь, пенобетон, хлеб, пористые тела в газе и т.д. |
| ж | тв | ж/тв | твердые эмульсии | вода в парафине, природные минералы с жидкими включениями, пористые тела в жидкости |
| тв | тв | тв/тв | твердые золи | сталь, чугун, цветные стекла, драгоценные камни: золь Au в стекле – рубиновое стекло (0,0001%) (1т стекла-1г Au) |
КЛАССИФИКАЦИЯ ПО МЕЖЧАСТИЧНОМУ ВЗАИМОДЕЙСТВИЮ
Согласно этой классификации ДС подразделяют на:
1) свободнодисперсные (бесструктурные);
2) связнодисперсные (структурированные).
В свободнодисперсных системах частицы дисперсной фазы не связаны друг с другом и способны независимо передвигаться в дисперсионной среде.
В связнодисперсных системах частицы дисперсной фазы связаны друг с другом за счет межмолекулярных сил, образуя в дисперсионной среде своеобразные пространственные сетки или каркасы (структуры). Частицы, образующие структуру, не способны к взаимному перемещению и могут совершать только колебательные движения.
