Тема 2.5. Хімічна рівновага
План
- Поняття про ланцюгові реакції.
- Стан хімічної рівноваги.*
3. Зміщення хімічної рівноваги. Принцип Ле Шательє.**
1. Досі ми з вами розглядали хімічні реакції, що відбуваються порівняно просто. У таких реакціях кожний елементарний акт взаємодії – кожне зіткнення між активними молекулами реагуючих речовин – відбувається незалежно від результатів попередніх елементарних актів. Утворення макроскопічних кількостей продукту реакції є тут результатом великої кількості таких актів, що не залежать один від одного.
Проте існує велика група реакцій, що відбуваються складніше. У цих реакціях можливість перебігу кожного елементарного акту спряжена з успішним проходженням попереднього акту і, в свою чергу, зумовлює можливість наступного. Тут утворення макроскопічних кількостей продуктів реакції є результатом ланцюга елементарних актів взаємодії. Такі реакції називаються ланцюговими.
Ланцюгові реакції відбуваються за участю активних центрів – атомів, йонів або радикалів, що мають неспарені електрони і виявляють внаслідок цього дуже високу активність. Роль активних центрів можуть відігравати, наприклад, атоми і групи атомів.
При актах взаємодії активних центрів з молекулами вихідних речовин утворюються молекули продукту реакції, а також нові активні частинки – нові активні центри, здатні до акту взаємодії.
Прости прикладом ланцюгової реакції може бути реакція синтезу хлороводню: H2 + Cl2 → 2HCl
Ця реакція спричинюється дією світла. Поглинання кванта променистої енергії молекулою хлору спричинює її збудження – появу в ній енергетичних коливань атомів. Якщо енергія коливань перевищує енергію зв’язків між атомами, то молекула розпадається. Це можна виразити рівнянням:
Cl2 + hν → 2Cl∙
Cl∙ + H2 → HCl + H∙
H∙ + Cl2 → HCl + Cl∙
В розглянутому випадку число ланок може досягати 100000. Закінчується ланцюг при зіткненні вільного атома з стінкою посудини, у якій відбувається реакція. Ланцюг може закінчитися також при такому зіткненні двох активних частинок і однієї неактивної, в результаті якого активні частинки сполучаються в молекулу, а енергія, що виділяється, виноситься неактивною частинкою.
2. Коли швидкості прямої і зворотної реакцій стають однаковими, настає хімічна рівновага. Хімічну рівновагу називають динамічною. Цим підкреслюється, що при рівновазі відбуваються пряма і зворотна реакції, але їхні швидкості однакові, внаслідок чого змін у системі не помітно.
Кількісною характеристикою хімічної рівноваги є величина, що називається константою хімічної рівноваги. Константа хімічної рівноваги – відношення констант швидкості прямої і зворотної реакцій.
Нехай в системі протікає обернена хімічна реакція між газоподібними речовинами N і M і утворюються газоподібні речовини D і G.
n N + m M ↔ d D + g G .
Константа хімічної рівноваги в цьому випадку може бути знайдена як:
КР = 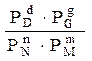 .
.
При сталій температурі К оборотної реакції є сталою величиною, що показує те співвідношення між концентраціями продуктів реакції і вихідних речовин, яке установлюється при рівновазі.
Величина константи рівноваги залежить від природи реагуючих речовин і температури.
2.3. Досягнувши стану хімічної рівноваги, система буде знаходитися в ньому до тих пір, доки не будуть змінені зовнішні умови. Це приведе до зміни параметрів системи, тобто до зсуву хімічної рівноваги в бік однієї з реакцій. Для якісного визначення напрямку зміщення рівноваги в хімічній реакції служить принцип Ле Шательє:
Якщо на систему, що знаходиться в рівновазі, подіяти ззовні, тобто змінити умови, при яких система знаходилась в рівновазі, то в системі з більшою швидкістю почнуть протікати процеси, що зменшують зовнішній вплив.
На стан хімічної рівноваги найбільше впливають концентрація, тиск і температура.
1) Збільшення концентрації вихідних речовин N і M приводить до збільшення швидкості прямої реакції. Збільшення концентрації продуктів зміщує рівновагу в бік протікання оборотної реакції.
2) тиск (для газів)
N2 + 3 H2 ↔ 2 NH3 .
В результаті протікання прямої реакції число молекул газів зменшився з 4 моль до 2 моль.
При підвищенні загального тиску рівновага зміщується в бік реакції, яка приводить до зменшення числа молекул газоподібних речовин, а при зменшенні тиску – в бік реакції, в якій збільшується число молекул газів.
3) температура
При підвищенні температури рівновага завжди зміщується в бік ендотермічної реакції. а при зниженні – в бік екзотермічної реакції.
Контрольні запитання:
- Коли настає стан хімічної рівноваги?
- Сформулюйте принцип Ле Шательє.
- Вкажіть фактори, які впливають на зміщення хімічної рівноваги.
- Як зміниться стан рівноваги в наведених реакціях при підвищенні тиску:
а) H2(г) + Cl2(г) ↔ 2HCl(г)
б) PCl3(г) + Cl2(г) ↔ PCl5(г)
в) 2CO(г) + O2(г) ↔ 2CO2(г)
- Як зміниться стан рівноваги в наведених реакціях при збільшенні температури:
а) 2SO2(г) + O2(г) ↔ 2SO3(г); ∆H<0
б) N2(г) + O2(г) ↔ 2NO(г); ∆H>0
в) CO2(г) + C ↔ 2CO (г); ∆H>0
Література:
- Глинка Н.Л. Общая химия: Учебное пособие для вузов. – Л.: Химия, 1979. – Гл. VІ, §§ 62-64, с. 181-190.
- Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. І, Гл. 4, §§ 33-35, с. 44-45.
