Химическое строение белков
Молекулы белков состоят из остатков аминокислот, соединённых в цепочку пептидной связью.
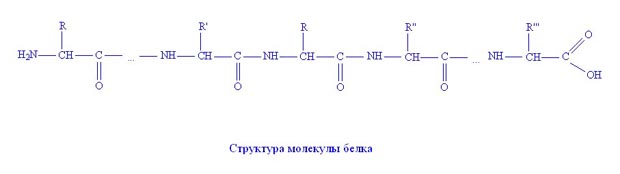
Пептидная связь возникает при образовании белков в результате взаимодействия аминогруппы (—NH2) одной аминокислоты с карбоксильной группой (—СООН) другой аминокислоты.
Из двух аминокислот образуется дипептид (цепочка из двух аминокислот) и молекула воды.
Десятки, сотни и тысячи молекул аминокислот, соединяясь друг с другом, образуют гигантские молекулы белков.
В молекулах белков многократно повторяются группы атомов -СО-NH-; их называютамидными, или в химии белков пептидными группами. Соответственно белки относят к природным высокомолекулярным полиамидам или полипептидам.
Общее число встречающихся в природе аминокислот достигает 300, однако некоторые из них достаточно редки.
Среди аминокислот выделяется группа из 20 наиболее важных. Они встречаются во всех белках и получили название альфа-аминокислот.
Всё многообразие белков в большинстве случаев образовано этими двадцатью альфа-аминокислотами. При этом для каждого белка строго специфичной является последовательность, в которой остатки входящих в его состав аминокислот соединяются друг с другом. Аминокислотный состав белков определяется генетическим кодом организма.
Белки и пептиды
И белки, и пептиды – это соединения, построенные из остатков аминокислот. Различия между ними колличественные.
Условно считают, что:
· пептиды содержат в молекуле до 100 аминокислотных остатков
(что соответствует молекулярной массе до 10 000), а
· белки – свыше 100 аминокислотных остатков
(молекулярная масса от 10 000 до нескольких миллионов).
В свою очередь в группе пептидов принято различать:
· олигопептиды (низкомолекулярные пептиды),
содержащие в цепи не более 10 аминокислотных остатков, и
· полипептиды, в состав цепи которых входит до 100 аминокислотных остатков.
Для макромолекул с числом аминокислотных остатков, приближающимся или немного превышающим 100, понятия полипептидов и белков практически не разграничиваются и часто являются синонимами.
Структура белков. Уровни организации.
Молекула белка это чрезвычайно сложное образование. Свойства белка зависят не только от химического состава его молекул, но и от других факторов. Например, от пространственной структуры молекулы, от связей между атомами, входящих в молекулу.
Выделяют четыре уровня структурной организации молекулы белка.
Первичная структура
Первичная структура представляет собой последовательность расположения остатков аминокислот в полипептидных цепях.
Последовательность остатков аминокислот в цепи является наиболее важной характеристикой белка. Именно она определяет основные его свойства.
Белок каждого человека имеет свою уникальную первичную структуру, связанную с генетическим кодом.
Вторичная структура.
Вторичная структура связана с пространственной ориентацией полипептидных цепей.
Её основные виды:
· альфа-спираль,
· бетта-структура (имеет вид складчатого листа).
Вторичная структура закрепляется, как правило, водородными связями между атомами водорода и кислорода пептидных групп, отстоящих друг от друга на 4 звена.
Водородные связи как бы сшивают спираль, удерживая полипептидную цепь в закрученном состоянии.
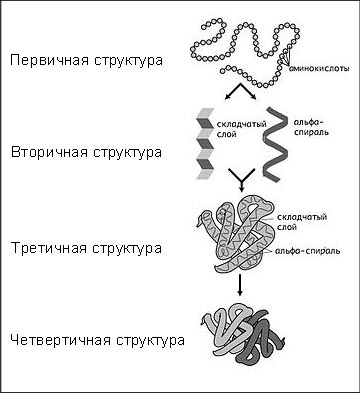
Третичная структура
Третичная структура отражает пространственную форму вторичной структуры.
Например, вторичная структура в форме спирали, в свою очередь, может иметь шаровидную или яйцевидную форму.
Третичная структура стабилизируется не только водородными связями, но и другими видами взаимодействия, например ионным, гидрофобным, а также дисульфидными связями.
Четвертичная структура
Первые три уровня характерны для структурной организации всех белковых молекул.
Четвёртый уровень встречается при образовании белковых комплексов, состоящих из нескольких полипептидных цепей.
