И их важнейших соединений. жесткость воды
Элементы, в атомах которых в последнюю очередь заполняются электронами последний энергетический уровень, подуровень s, называют s-элементами. На внешнем энергетическом уровне атомов s-элементов у щелочных металлов по 1 электрону, у щелочноземельных – по 2 электрона. В периодической системе элементов Д. И. Менделеева s-элементы располагаются соответственно в главных подгруппах первой и второй группы. Имея невысокие значения потенциала ионизации (4–9 эВ), они обладают высокой химической активностью.
Увеличение атомного радиуса и уменьшение потенциала ионизации приводит к усилению активности s-металлов по мере роста их порядкового номера, т. е. сверху вниз в группах периодической системы. По отношению к s-металлам все элементы с высокой электроотрицательностью – окислители, в том числе и водород. Они образуют с этими металлами гидриды, оксиды, пероксиды, сульфиды и т. п. Щелочные металлы образуют оксиды и гидроксиды – хорошо растворимые в воде щелочи. Растворимость гидроксидов щелочноземельных металлов значительно меньше, чем щелочных. Плохо растворимы Ве(ОН)2 и Мg(ОН)2. В отличие от гидроксидов всех s-элементов Ве(ОН)2 обладает амфотерными свойствами, что объясняется наименьшим радиусом иона (0,034 нм) и наличием только двух электронов в предпоследнем энергетическом уровне, тогда как у остальных s-элементов в предпоследнем энергетическом уровне находится восемь электронов (кроме лития). Получают s-металлы главным образом электролизом их расплавленных солей.
Повышенное содержание в воде растворенных солей кальция и магния обусловливает жесткость воды. Жесткость – один из технологических показателей, принятый для характеристики состава и качества природных вод. Жесткость воды выражается суммой миллиэквивалентов ионов Са+2 и Мg+2 или суммой миллимолей этих ионов, содержащихся в 1 л воды (мэкв/л, или ммоль/л). 1 ммоль/л (1 мэкв/л) жесткости отвечает содержанию в 1 л воды 20,04 мг Са+2 или 12,16 мг Мg+2.
Различают следующие виды жесткости:
1) карбонатную (временную), обусловленную присутствием в воде гидрокарбонатов кальция и магния – Са(НСО3)2 и Мg(НСО3)2, переходящих при кипячении воды в малорастворимые карбонаты и гидроксиды кальция и магния, выпадающие в осадок;
2) некарбонатную (постоянную) жесткость, обусловленную присутствием в воде хлоридов, нитратов, сульфатов, силикатов магния и кальция. Соли постоянной жесткости при кипячении не удаляются;
3) общую жесткость, представляющую собой сумму карбонатной и некарбонатной жесткости.
Для устранения жесткости воды используют термический, реагентный и ионообменный методы.
Термический метод заключается в нагревании воды до 95–98 °С, при этом гидрокарбонатные ионы НСО3- переходят в карбонатные СО32– и с ионами кальция и магния образуют нерастворимые СаСО3 и MgСО3:
Са+2 + СО3-2 ® ¯СаСО3; Mg+2 + СО3-2 ® ¯MgСО3
Реагентные методы основаны на удалении из воды ионов кальция и магния в виде нерастворимых соединений. Так, при содово-известковом методе карбонатную жесткость устраняют добавлением к воде гашеной извести. При этом гидрокарбонат кальция переходит в карбонат, а гидрокарбонат магния в гидроксид магния:
Са(НСО3)2 + Са(ОН)2 ® ¯2СаСО3 + 2Н2О
Мg(НСО3)2 + Cа(ОН)2 ® ¯Мg(ОН)2 + ¯СаСО3 + Н2О + СО2
Некарбонатную жесткость устраняют добавлением соды, которая вызывает образование осадка:
СаSО4 + Na2СО3 ® ¯СаСО3 + Na2SО4
Более глубокое удаление достигается при обработке воды солями фосфорных кислот, например Na3РО4:
3СаСl2 + 2Na3РО4 ® ¯Са3(РО4)2 + 6NaСl
Наиболее эффективным и широко распространенным в настоящее время методом умягчения воды является ионообменный метод. Заключается он в пропускании жесткой воды через слой катионитов (синтетических ионообменных смол), содержащих функциональные группы, способные обмениваться на катионы магния и кальция:
Cа(НСО3)2 + Na2R ® CaR+ 2NaНСО3
MgSО4 + Na2R ® МgR + Na2SО4
где R – радикал сложной молекулы катиона.
При решении задач, связанных с жесткостью воды, рационально использовать закон эквивалентов. Не составляя уравнений химических реакций, можно сказать, что, например, для устранения жесткости, равной 2,2 мэкв, нужно 2,2 мэкв вещества, устраняющего жесткость. Если на устранение жесткости 1 л воды пошло 3 мэкв вещества, то жесткость воды равна 3 мэкв.
Рассчитать жесткость воды, а также массу вещества, которую нужно добавить к жесткой воде для устранения жесткости, можно по формуле
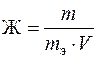 (19.1)
(19.1)
где Ж – жесткость воды, мэкв/л или ммоль/л; m – масса вещества, определяющего жесткость воды, или масса вещества, добавляемого к воде для устранения жесткости, мг; V – объем воды, л; mэ – эквивалентная масса вещества, определяющего жесткость воды или добавляемого к воде для устранения жесткости, мг/моль.
Пример 1. Вычислить жесткость воды, зная, что в 500 л ее содержится 202,5 г Са(НСО3)2.
Решение. В 1 л воды содержится 202,5 : 500 = 0,405 г Са(НСО3)2, что составляет 0,405 : 81 = 0,005 эквивалентных масс или 5 мэкв/л. (81 г/моль – эквивалентная масса Са(НСО3)2.) Следовательно, жесткость воды равна 5мэкв/л.
Пример 2.Какую массу соды надо добавить к 500 л воды, чтобы устранить ее жесткость,равную 5мэкв/л?
Решение. В 500 л воды содержится 500 × 5 = 2500 мэкв солей, обусловливающих жесткость воды. Для устранения жесткости следует прибавить 2500 × 53 = 132500 мг = 132,5 г соды (53 г/моль – эквивалентная масса Na2СО3).
Пример 3. Вода, содержащая только сульфат магния, имеет жесткость 7 ммоль/л. Какая масса сульфата магния содержится в 300 л этой воды?
Решение. Применяем формулу (19.1): m = Ж × mэ × V. Сульфат магния имеет эквивалентную массу, равную 60 мг/ммоль. Тогда получаем: m = 7 × 60 × 300 = 126000 мг, или 126 г. Ответ: масса сульфата магния равна 126 г.
ЗАДАЧИ
19.1. Написать уравнения реакций натрия с водородом, кислородом, азотом и серой. Какую степень окисления приобретают атомы окислителя в каждой из этих реакций?
19.2. Рассчитать, сколько граммов Са(НСО3)2 содержится в 1 м3 воды, жесткость которой равна 3 мэкв/л.
Ответ: 243 г.
19.3. Что такое поташ? Как получить поташ, имея в распоряжении вещества К2SО4, Ва(ОН)2, СаСО3, НСl и Н2О? Составить уравнения соответствующих реакций.
19.4. Определить карбонатную жесткость воды, в 1 л которой содержится по 100 мг Cа(НСО3)2 и Mg(НСО3)2.
Ответ: 2,6 ммоль/л.
19.5. Составить уравнения реакций, которые нужно провести для осуществления превращений
Cа ® СаН2 ® Cа(ОН)2 ® СаСО3 ® Cа(НСО3)2 ® CaСl2 ® Cа (NО3)2
19.6. Чему равна жесткость воды, в 10 л которой содержится 6 г CaСl2?
Ответ: 10,81 ммоль/л.
19.7. На какой реакции основано получение гидридов щелочных металлов? Составить уравнения реакций гидролиза гидрида натрия и электролиза расплава гидрида лития.
19.8. Чему равна жесткость воды, если для ее устранения к 100 л воды потребовалось прибавить 15,9 г соды?
Ответ: 3 ммоль/л.
19.9. Являясь сильными восстановителями, магний, кальций и барий применяются в металлотермии для получения металлов из их оксидов. Составить электронные и молекулярные уравнения реакций кальция: а) с Cr2O3; б) V2O5.
19.10. Сколько граммов соды нужно прибавить к 5 м3 воды, чтобы устранить жесткость, равную 2,5 мэкв/л?
Ответ: 662,5 г.
19.11. Составить уравнения реакций, которые нужно провести для осуществления превращений
Ве® ВеСl2 ® Ве(ОН)2 ® Na2[Ве(ОН)4] ® ВеSО4
19.12. Определить жесткость воды, в 1 л которой содержится 0,324 г гидрокарбоната кальция. Сколькограммов соды нужно прибавить к 2 м3 этой воды для устранения ее жесткости?
Ответ: 4 ммоль/л, 424 г.
19.13. Составить электронные и молекулярные уравнения реакций: а) бериллия с концентрированным раствором гидроксида натрия; б) магния с концентрированной серной кислотой при максимальном восстановлении последней до сероводорода.
19.14. Рассчитать жесткость воды, содержащей в 1 л 0,005 моль гидрокарбоната кальция.
Ответ: 10 ммоль/л.
19.15. Какие вещества образуются при горении кальция на воздухе? Почему при смачивании полученного продукта водой выделяется значительное количество теплоты? Составить уравнения соответствующих реакций.
19.16. Чему равна жесткость воды, в 100 л которой содержится 14,632 г гидрокарбоната магния?
Ответ: 2 ммоль/л.
19.17. Оксид бериллия при сплавлении взаимодействует с SiO2 и Na2O. Написать уравнения соответствующих реакций. О каких свойствах BeO говорят эти реакции?
19.18. Минеральная вода содержит 0,3894 г/л ионов кальция и 0,0844 г/л ионов магния. Какова жесткость этой воды?
Ответ: 26,5 ммоль/л.
19.19. При нагревании с графитом кальций и бериллий образуют карбиды. В карбиде кальция углерод имеет степень окисления -1, а в карбиде бериллия -4. Составить электронные и молекулярные уравнения получения соответствующих карбидов. Какие соединения образуются при взаимодействии этих карбидов с водой?
19.20. Вычислить жесткость воды, зная, что для ее устранения пришлось к 50 л воды прибавить 10,8 г безводной буры Na2В4О7.
Ответ: 2,15 ммоль/л.
19.21. Составить уравнения реакций, которые нужно провести для осуществления следующих превращений:
Mg ® MgО ® Mg(ОН)2 ® MgСО3 ® MgСl2 ® MgSiO3
19.22. Сколько граммов соды нужно добавить к 200 л воды, чтобы устранить ее жесткость, равную 3,8 мэкв/л?
Ответ: 40,28 г.
19.23. Составить электронные и молекулярные уравнения реакций: а) кальция с водой; б) магния с азотной кислотой, учитывая, что окислитель приобретает низшую степень окисления.
19.24. В 220 л воды содержится 11 г сульфата магния. Чему равна жесткость этой воды?
Ответ: 0,83 ммоль/л.
19.25. Какие соединения называют негашеной и гашеной известью? Составить уравнения реакций их получения. Какие соединения получаются при прокаливании негашеной извести с углем? Составить электронные и молекулярные уравнения реакций.
19.26. Жесткая вода содержит в литре 50 мг Ca(НСО3)2 и 15 мг СаSО4. Сколько граммов карбоната натрия потребуется для устранения жесткости 1 м3 этой воды?
Ответ: 44,41 г.
19.27. Составить уравнения реакций, происходящих при насыщении гидроксида натрия: а) хлором; б) оксидом серы SО3; в) сероводородом.
19.28. Некарбонатная жесткость воды равна 3,18 мэкв/л. Сколько ортофосфата натрия надо взять, чтобы устранить жесткость 1 м3 этой воды?
Ответ: 173,9 г.
19.29. При пропускании диоксида углерода через известковую воду (раствор Cа(ОН)2) образуется осадок, который при дальнейшем пропускании СО2 растворяется. Дать объяснение этому явлению. Составить уравнения реакций.
19.30. Какую массу гидроксида кальция надо прибавить к 275 л воды, чтобы устранить ее карбонатную жесткость, равную 5,5 мэкв/л?
Ответ: 56 г.
19.31. Составить уравнения реакций, которые нужно провести для осуществления следующих превращений:
К ® К2О ® КОН ® К2СО3 ® КСl ® КNO3
19.32. Какая масса CаSO4 содержится в 200 л воды, если жесткость, обусловленная этой солью, равна 8 мэкв/л?
Ответ: 108,8 г.
19.33. Определить % мас. примесей в техническом карбиде кальция, если при полном разложении 1,8 кг образца водой образовалось 560 л ацетилена (н. у.).
Ответ: 11,1 %.
19.34. Закончить уравнения реакций:
а) Be + NaOH + H2O ® б) BeF2 + NaF ®
19.35. Пероксид натрия применяется в изолирующих противогазах для регенерации кислорода. Составить электронные и молекулярные уравнения реакции пероксида натрия с углекислым газом. К какому типу окислительно-восстановительных реакций относится этот процесс?
19.36. Закончить уравнения реакций:
а) Be(OH)2 + NaOH ®
б) MgCl2 + Na2CO3 + H2O ® (MgOH)2CO3 +...
19.37. Определить массовую долю разложившегося карбоната стронция, %, если при прокаливании 10 кг материала его масса уменьшилась на 1,7 кг.
Ответ: 57 %.
19.38. Вычислить жесткость воды, зная, что для удаления ионов кальция, содержащихся в 50 л этой воды, потребовалось прибавить к воде 21,6 г безводной буры Na2В4О7.
Ответ: 4,3 ммоль/л.
19.39. При растворении в кислоте 7,5 г оксида кальция, содержащего примесь карбоната кальция, выделилось 0,21 л газа. Какова массовая доля (%) карбоната кальция в исходной смеси?
Ответ: 12,5 %.
19.40. Какую массу соды Na2CO3 надо добавить к 30 л воды, чтобы устранить жесткость воды, равную 4,64 ммоль/л?
Ответ: 7,38 г.
19.41. Объяснить, почему при реакции натрия и калия с водой часто возникает пламя, а кальций реагирует с ней довольно спокойно, без возгорания. Привести уравнения реакций.
19.42. Как различить указанные вещества? Привести соответствующие реакции: а) MgCl2 и BaCl2; б) KNO3 и Mg(NO3)2.
19.43. При сгорании магния на воздухе образуется смесь двух веществ. Привести уравнения реакций их образования.
19.44. Составить уравнения химических реакций, позволяющих осуществить следующие превращения:
Ca ® CaCl2 ® CaCO3 ® Ca(HCO3)2 ® CaCO3 ® CaCl2 ® Ca.
19.45. При растворении в воде 1,75 г щелочного металла выделилось 2,8 л водорода (н. у.). Определить металл.
19.46. Составить схему гидролиза BeCl2.
19.47. В 150 г воды растворили 11,2 г лития. Рассчитать процентную концентрацию полученного раствора. Написать уравнение соответствующей реакции.
Ответ: 24,1 %.
19.48. Вычислить температуру начала разложения ВаСО3 и CaСО3.
Ответ: 1297 °С; 808 °С.
19.49. Используя только известняк (карбонат кальция) и воду, получить гашеную и негашеную известь.
19.50. Как изменяется химическая активность по отношению к кислороду и хлору в ряду Be – Mg – Са? Привести соответствующие реакции.
19.51. Сколько граммов натрия надо добавить к 100 г воды, чтобы получить 15 %-й раствор гидроксида натрия?
Ответ: 9,41 г.
19.52. Какие соединения составляют основу жидкого (растворимого) стекла? Составить уравнения гидролиза этих солей.
19.53. Имеется смесь карбонатов калия и кальция. Предложить схему получения чистых металлов из этой смеси.
19.54. Привести примеры химических реакций, доказывающих амфотерный характер Be, BeO и Be(OH)2.
19.55. Можно ли получить кальций восстановлением его оксида алюминием в стандартных условиях? Ответ обосновать расчетом энергии Гиббса реакции.
19.56. Написать уравнения реакций, соответствующие следующей схеме:
Na ® NaOH ® NaHCO3 ® Na2CO3 ® NaCl ® NaOH
19.57. Написать уравнения реакций взаимодействия гидрида кальция: а) с кислородом; б) с водой.
19.58. Написать уравнения реакций, соответствующие схеме, определить возможные вещества Х1 и Х2:
MgSO4 ® X1 ® MgCl2 ® X2 ® Mg(OH)2
19.59. Рассчитать, сколько теплоты выделяется при гашении 1 кг негашеной извести.
Ответ: 1161,1 кДж.
19.60. Привести уравнения реакций, соответствующие следующей схеме:
K ® KH ® KOH ® KNO3 ® KNO2 ® K2SO4 ® KCl ® Cl2
Раздел 20. Химия строительных материалов
Вяжущие вещества
Вяжущими веществами называются материалы, способные при смешивании с водой образовывать пластично-вязкую массу, которая, постепенно затвердевая, превращается в камневидное тело.
По условиям твердения и водостойкости продуктов твердения вяжущие вещества разделяются на воздушные и гидравлические. Воздушные вяжущие твердеют на воздухе, а продукты их твердения нестойки в воде (воздушная известь, гипсовые и магнезиальные вяжущие). Гидравлические вяжущие твердеют на воздухе, а продукты их твердения длительно сохраняют прочность в воде (гидравлическая известь, портландский, глиноземистый, пуццолановый цементы).
Воздушную известь получают путем обжига карбонатных пород (известняка, мела, доломитизированных известняков) при температуре 1000 – 1200 °С:
CaCO3 ® CaO + CO2
В результате химической диссоциации CaCO3 разрушается кристаллическая решетка кальцита и получается оксид кальция с сильно разрыхленной структурой. При гашении воздушная известь взаимодействует с водой с выделением большого количества теплоты:
CaO + H2O ® Ca(OH)2, DH°х.р = -65 кДж.
Твердение известково-песчаного раствора происходит в результате карбонизации Ca(OH)2 углекислым газом из воздуха:
Ca(OH)2 + CO2 ® CaCO3 + H2O
Портландский цемент – гидравлическое вяжущее вещество, твердеющее и в воде, и на воздухе. Для производства портландцемента используют известняки и глины, которые берутся в соотношении 3:1 (по массе). Химический состав выражается в виде оксидов в % мас.:
CaO – 62...68; SiO2 – 18...26; Al2O3 – 4...9; Fe2O3 – 0,3...0,6.
Цементный клинкер представляет собой систему из нескольких искусственно образованных минералов, полученных при обжиге сырьевой смеси и состоит из тонкозернистых кристаллических и аморфных фаз. Минералогический состав цементного клинкера, % мас.:
3CaO×SiO2 трехкальциевый силикат (алит) – 40…65
2CaO×SiO2 двухкальциевый силикат (белит) – 15…40
3CaO×Al2O3 трехкальциевый алюминат (целит) – 5…15
4CaO×Al2O3×Fe2O3 четырехкальциевый алюмоферрит
(браунмиллерит) 10…20
При взаимодействии минералов цементного клинкера с водой происходят их гидролиз и гидратация с образованием гидратных соединений:
3CaO×SiO2 + (n + 1)H2O ® 2CaO×SiO2×nH2O + Ca(OH)2
2CaO×SiO2 + nH2O ® 2CaO×SiO2×nH2O
3CaO×Al2O3 + 6H2O ® 3CaO×Al2O3×6H2O
4CaO×Al2O3×Fe2O3+ (m+6)H2O ®3CaO×Al2O3×6H2O + CaO×Fe2O3×mH2O
