Робота 3. Розрахувати ДР запропонованої викладачем солі
Кожна ланка (2-3 студентів) одержує від викладача завдання розрахувати ДР конкретної солі [AgCl, Ag2CrO4, BaSO4, Ca3(PO4)2, Mg(OH)2, CaCO3, Fe(OH)3, CaSO4] за наступною схемою:
а) записати рівняння реакції дисоціації:
AgCl ↔ Ag+ + Cl-
тверда фаза насичений розчин
б) рівняння константи рівноваги:
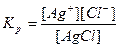
в) враховуючи, що тверда фаза не входить у рівняння константи рівноваги, тоді дістанемо:
Ks = [Ag+][Cl-]
У насиченому розчині малорозчинного електроліту при певній температурі добуток молярних концентрацій йонів є величиною сталою. Цю константу називають добутком розчинності.
ДР(AgCl) = Ks = [Ag+][Cl-]
Якщо відомо, що концентрація насиченого розчину AgCl при 250С 1,86*10-3 г в 1 л, то визначаємо молярну концентрацію розчину:
М(AgCl) = 143,3 г/моль 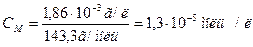
Із кожного моль AgCl маємо 1 моль/л [Ag+] і 1 моль/л [Cl-]
Тоді добуток розчинності:
ДР(AgCl) =(1,3*10-5)2 = 1,78*10-10 моль2/л2
Якщо записувати для електроліту у загальному вигляді.
AmBn↔mA++ nB-
ДР(AmBn) = [A+]m∙[B-]n
За даною схемою розрахувати ДР для запропонованої вам солі і зробити відповідний висновок.
Література
- Клименко А.О., Мельник М.В., Павлюк В.М., Нечитайло Л.Я., Хопта Н.С., Коцаба М.В. Навчально-методичний посібник з фізичної та колоїдної хімії для студентів вищих медичних навчальних закладів. Івано-Франківськ, 2004.
- Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія, Вінниця, «Нова книга», 2006.
Підготувала: доцент кафедри Мельник М.В.
Обговорено і затверджено
на засіданні кафедри
протокол №1 від 28.08.20012р.
Зав. кафедрою біологічної та медичної хімії проф. А.М.Ерстенюк
Заняття 9
Тема: Буферні системи, класифікація та механізм дії.
Актуальність теми:Буферні системи є необхідними компонентами для існування живих організмів. У крові і інших біологічних рідинах є відповідні буферні системи, що підтримують майже стале значення рН. Знання складу буферних розчинів, механізму підтримання його рН, має важливе значення для розуміння механізмів дії буферних систем і регулювання основних фізіологічних процесів в організмі.
Навчальні цілі:
Знати: склад основних буферних систем організму, механізм їх дії, вплив на них кислотних і основних факторів.
Вміти:готувати буферні розчини, розраховувати значення рН цих розчинів за їх складом та розраховувати співвідношення компонентів буферного розчину за заданим значенням рН.
Самостійна позааудиторна робота студентів.
1. Дати визначення буферних систем, вказати їх хімічний склад.
2. Механізм дії буферної системи на прикладі ацетатного буферу.
3. Фактори від яких залежить рН буферних систем.
3. Вплив розведення буферних систем на рН.
4. Формули для визначення активної кислотностіаболужності буферних розчинів.
5. Механізм дії буферних розчинів:
а). гідрокарбонатного буферу;
б) фосфатної буферної системи;
в) білкових буферних систем.
6. Приготування буферних розчинів за даним значенням рН і розрахунок рН буферу за відомим співвідношенням компонентів буферної системи.
7. Буферні криві та їх характер.
8. Буферні системи крові.
Контрольні питання.
1. Наведіть приклади буферних розчинів утворених слабкою кислотою і її сіллю.
2. Наведіть приклади буферних розчинів утворених слабкою основою і її сіллю.
3. Наведіть приклади буферних розчинів утворених солями багатоосновних кислот.
4. Напишіть рівняння реакції дії на гідрокарбонатний буферний розчин кислоти, лугу.
4. Напишіть рівняння реакції дії на фосфатний буферний розчин кислоти, лугу.
5. Напишіть рівняння реакції дії на ацетатний буферний розчин лугу, кислоти.
6. Напишіть рівняння реакції дії на білковий буферний розчин кислоти, лугу.
7. Як розрахувати рН кислотного буферного розчину?
8. Як розрахувати рН основного буферного розчину?
9. Що таке буферний розчин? Фактори від яких залежить рН буферного розчину.
10.Як розрахувати рН буферного розчину?
11.Аміачна буферна система складається з 100 мл розчину гідроксиду амонію з молярною концентрацією еквівалентів 0,1 моль/л і 50 мл хлориду амонію з молярною концентрацією еквівалентів 0,2 моль/л. ( 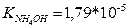 ). Визначити рН даної системи.
). Визначити рН даної системи.
12.Як зміниться рН даного аміачного буферу при доливанні до нього 10 мл розчину кислоти з молярною концентрацією еквівалентів 0,2 моль/л.
13.Розрахуйте які об’єми розчинів гідрофосфату і дигідрофосфату натрію з молярними концентраціями еквівалентів 0,1 моль/л треба взяти для приготування 100 мл буферного розчину з рН 6,8. ( 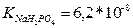 )
)
14.Як зміниться рН даного фосфатного буферу при доливанні до нього 40 мл розчину лугу з молярною концентрацією еквівалентів 0,1 моль/л.
Самостійна робота на занятті.
Виконати лабораторні роботи
1. Приготувати ацетатний буферний розчин за заданим співвідношенням компонентів.
2. Приготувати буферний розчин за відомим значенням рН.
3. Вивчити властивості буферного розчину.
Методика виконання роботи
Робота 1. Приготування ацетатного буферного розчину за заданим співвідношенням компонентів.
Кожна пара студентів готує 10 мл ацетатного буферу змішуючи 0,1 н розчини оцтової кислоти і ацетату натрію з вказаним викладачем співвідношенням (кислота:сіль=9:1;8:2; 7:3; 6:4; 5:5; 4:6; 3:7; 2:8; 1:9).
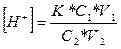
Концентрацію водневих іонів в буферному розчині визначають за формулою:
де К- константа дисоціації оцтової кислоти (1,8*10-5);
С1, V1, - об'єм і еквівалент розчину кислоти;
С2, V2 - еквівалент і об'єм розчину солі.
На основі знайденої концентрації водневих іонів буферного розчину вираховують рН за формулою:
рН = -lg [Н+].
Одержані дані занести в таблицю.
| №п/п | Vкислоти | Vсолі | [H+] | рН |
За співвідношенням компонентів і рН буферних розчинів будують буферну криву в координатах рН®VK.
Робота 2. Приготування буферного розчину за відомим рН.
Студенти одержують завдання від викладача на приготування 10 мл буферного розчину з певним значенням рН. За відомим значенням рН розраховують концентрацію йонів водню в розчині.
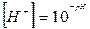
Об'єм розчину кислоти і солі визначають за формулою:
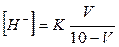
 де К- константа дисоціації оцтової кислоти (1,8 • 10-5);
де К- константа дисоціації оцтової кислоти (1,8 • 10-5);
V - об'єм розчину кислоти; 10-V -об'єм розчину солі.
Робота 3. Властивості буферного розчину.
Необхідно перевірити, чи змінюється рН буферної суміші при доливанні кислоти або лугу (збільшенні концентрації), або доливанні води (зменшенні концентрації). Для цього в 4 пробірки налити по 2 мл приготовленого буферного розчину (роб.1). В першу пробірку прилити 2 кр 0,1М NaOH, в другу – 2 кр. 0,1 М НСІ, в третю – 2 кр. Н2О. Четверта пробірка служить еталоном. В кожну пробірку прилити по 2-3 кр індикатора метилоранжу. Що спостерігається? Записати рівняння відповідних реакцій.
Література
- Клименко А.О., Мельник М.В., Павлюк В.М., Нечитайло Л.Я., Хопта Н.С., Коцаба М.В. Навчально-методичний посібник з фізичної та колоїдної хімії для студентів вищих медичних навчальних закладів. Івано-Франківськ, 2004.
- Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія, Вінниця, «Нова книга», 2006.
Підготував: доцент кафедри Павлюк В.М.
Обговорено і затверджено
на засіданні кафедри
протокол №1 від 28.08.20012р.
Зав. кафедрою біологічної та медичної хімії проф. А.М.Ерстенюк
Заняття 10
