Диаграммы фазового равновесия
Состояние однокомпонентных систем определяют две независимые переменные: давление и температура.
Число степеней свободы равновесной термодинамической системы, на которую влияют только температура и давление, равно числу компонентов системы минус число фаз плюс 2, т.е. S = к – ф + 2 (по правилу фаз Гиббса).
В однокомпонентной системе одновременно могут существовать три фазы: твердая, жидкая и парообразная и возможны следующие двухфазные равновесия:
1) жидкая фаза – твердая фаза
2) жидкая фаза – пар
3) твердая фаза – пар
Каждое из этих равновесий характеризуется определенной кривой Р = f(Т). Положение кривых определяется уравнением Клапейрона – Клаузиуса:
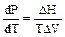
Графическое изображение состояния равновесных фаз при разных температурах и давлениях называется диаграммой состояния.
Состояние системы изображается частью плоскости, которая называется фазовым полем.
Фазовое поле – геометрическое место точек, изображающих различные состояния одной и той же фазы.
Фазовые поля разделены фазовыми линиями.
Диаграмма состояния воды
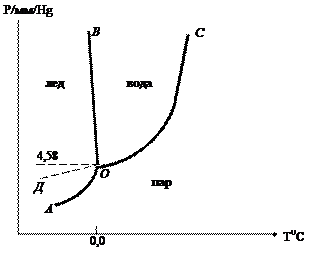 |
Рисунок 3. Диаграмма состояния воды
|
Число степеней свободы в этой точке определяется по формуле S = к – ф + 2 = 1 – 3 + 2 = 0.
Если изменить в этой точке одну из переменных, то исчезнет одна из фаз. Например, если увеличить температуру, то исчезнет твердая фаза. Пока исчезает твердая фаза, температура не изменится.
После исчезновения твердой фазы останется двухфазная система жидкость – пар. Она моновариантна т.е. S = 1 – 2 + 2 = 1.
Следовательно, изображается фазовой линией.
Линия ОС отображает равновесие жидкость – пар. В этой системе можно менять либо давление, либо температуру. Если увеличить температуру, то давление будет увеличиваться и фигуративная точка будет двигаться вверх по кривой ОС. Точка С – это критическая точка, выше которой жидкость не может существовать, т.к. Т = 647,35 К; Р = 221,406 Па.
Линию ОС можно продолжить в обратную сторону за тройную точку О (линия ОД). Она соответствует равновесию пар – переохлажденная жидкость, т.е. показывает давление пара над переохлажденной водой. Оно всегда выше, чем давление пара надо льдом. Поэтому переохлажденная вода является неустойчивой (метастабильной) фазой относительно льда, который в этой области температур устойчив.
При понижении температуры (в точке О) исчезает жидкость. Система станет двухфазной: лед – пар, моновариантной (кривая АО). Линия ОВ соответствует кривой плавления (или кристаллизации).
Число степеней свободы в любой точке, принадлежащей какой-либо фазовой линии, отражающей двух фазное равновесие, равно 1, т.е. S = 1 – 2 + 2 = 1.
Это значит, чтобы в системе сохранялось равновесие, можно изменить лишь один из параметров (либо температуру, либо давление).
Зависимость давления от температуры описывается уравнением Клаузиуса – Клапейрона.
Рассмотрим конкретные случаи его применения.
 а) Равновесие жидкость пар; DНисп > 0,
а) Равновесие жидкость пар; DНисп > 0,
тогда 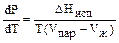
Так как удельный мольный объем пара больше соответствующего объема жидкости, т.е. Vп >Vж, то 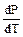 и значит
и значит 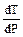 всегда положительна. Следовательно, температура испарения всегда повышается с ростом давления. Величина
всегда положительна. Следовательно, температура испарения всегда повышается с ростом давления. Величина 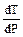 отражает наклон кривой и показывает изменение температуры с увеличением давления.
отражает наклон кривой и показывает изменение температуры с увеличением давления.
 б) Равновесие твердое жидкость; DНпл (кривая ОВ)
б) Равновесие твердое жидкость; DНпл (кривая ОВ)
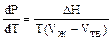 ; DV = (Vж – Vтв) – очень мала
; DV = (Vж – Vтв) – очень мала
Следовательно, 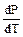 очень велика и кривая равновесия твердое тело – жидкость (ОВ) идет круто вверх.
очень велика и кривая равновесия твердое тело – жидкость (ОВ) идет круто вверх.
Следует обратить внимание, что для таких веществ, как вода, висмут, галлий в твердом состоянии имеют плотность меньше, чем в охлажденном состоянии.
Для них Vж >Vтв, т.е. Vж – Vтв < 0
Поэтому производная отрицательна и кривая плавления наклонена несколько влево.
Диаграмма состояния серы
В однокомпонентных системах может быть только одна паровая и одна жидкая фаза, а твердых фаз может быть несколько. У серы, например, существует две модификации: ромбическая Sромб и моноклинная Sмонокл (рисунок 4).
 |
Рис. 4. Диаграмма состояния серы
|
При нагревании обычной серы выше 95,50С она постепенно превращается в моноклинную Sмонокл
Таким образом, число возможных фаз для серы равно 4: ромбическая (твердая), моноклинная (твердая), жидкая и парообразная.
Сплошные линии делят диаграмму на четыре области:
область выше ДАВЕ – однофазная область ромбической твердой серы;
АВС – однофазная область твердой моноклинической серы;
EBCF – однофазная область серы в жидком состоянии;
область ниже ДАСF – однофазная область парообразной серы.
Каждая кривая этой диаграммы отражает соответствующие фазовые равновесия:
 АВ – Sромб Sмонокл
АВ – Sромб Sмонокл
ВС – Sмонокл Sжид
АС – Sмонокл Sпар
АД – Sромб Sпар
ВЕ – Sромб Sжид
CF – Sжид Sпар
 В точке А: Sромб Sмонокл Sпар
В точке А: Sромб Sмонокл Sпар
В: Sромб Sмонокл Sжид
С: Sмонокл Sжид Sпар
Число степеней свободы в этих точках равно 0: S = 1 – 3 + 2 = 0
Предполагаемая четвертая точка, отвечающая равновесию
 Sмонокл Sжид Sпар
Sмонокл Sжид Sпар
практически трудно осуществимо, т.к. это равновесие метастабильное.
Равновесие всех четырех фаз
 Sромб Sмонокл Sжид Sпар
Sромб Sмонокл Sжид Sпар
не может быть осуществимо ни при каких условиях, т.к. правило фаз для этого равновесия приводит к отрицательному числу степеней свободы:
S = 1 – 4 + 2 = – 1
 Итак, сера при нагревании может превращаться из ромбической в моноклинную. Возможен и обратный процесс, т.е. при охлаждении переход серы из моноклинной в ромбическую Sмонокл Sромб.
Итак, сера при нагревании может превращаться из ромбической в моноклинную. Возможен и обратный процесс, т.е. при охлаждении переход серы из моноклинной в ромбическую Sмонокл Sромб.
Таким образом, взаимные превращения одной кристаллической формы серы в другую протекает обратимо.
Если данная модификация кристаллического вещества обладает свойством при изменении внешних условий (например, температуры) переходить в другую модификацию и при восстановлении прежних условий возвращаться в первоначальную модификацию, то такие полиморфные превращения называются энантиотропными).
Примером энантиотропного фазового перехода может служить процесс взаимного перехода серы ромбической и серы моноклинической.
Превращения модификаций, которые могут протекать в одном направлении называются монотропными (бензофенон).
Двухкомпонентные системы
При изучении систем, состоящих их двух компонентов, используется метод графического изображения зависимости какого-либо свойства раствора от его концентрации.
Такое графическое изображение называют диаграммой состав – свойство.
Обычно диаграмма должна укладываться на плоскость, ограниченную осями ординат и абсцисс (рисунок 5).

Рис. 5. Диаграмма состав – свойство
На оси ординат откладывается любое свойство (температура, давление, плотность, показатель преломления и т.д.).
На оси абсцисс откладывают состав бинарной смеси, который может быть выражен в мольных долях или в процентах.
Левая точка А соответствует 100%-му содержанию компонента А, правая точка В соответствует 100%-му содержанию компонента В. Промежуточные точки между А и В соответствуют смесям, состоящим из двух компонентов. По мере удаления от точки А уменьшается содержание компонента А, но возрастает содержание компонента В.
|
Если смешать какие-либо две жидкости, которые ограниченно растворимы друг в друге, то через некоторое время произойдет расслоение и получится система, состоящая из двух сопряженных растворов, находящихся в равновесии. Один из них представляет собой раствор первой жидкости во второй, другой – раствор второй жидкости в первой.
Содержание обоих жидкостей в этих двух сопряженных растворах зависит от состава и от температуры. При некотором соотношении компонентов и при определенной температуре может наблюдаться полная взаимная растворимость жидкостей.
Для изображения зависимости взаимной растворимости жидкостей от температуры при постоянном давлении строят диаграмму состояния в координатах температура – состав, которая называется диаграммой растворимости.
