В аналитической химии используются
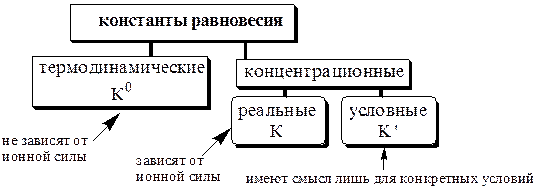
Для равновесия aA + bB › cC + dD
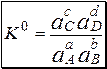
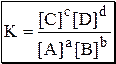
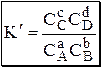
Подравновесной концентрацией (обозначают - [ ]) понимают концентрацию определённой формы вещества, участвующего в равновесии. Сумма равновесных концентраций всех форм существования данного вещества называется его общей концентрацией (С), например, для аммиака - 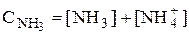 .
.
Отношение равновесной концентрации определённой формы вещества к общей концентрации этого вещества называется молярной долей данной формы вещества, например:
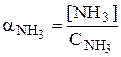
Различные виды констант равновесия связаны между собой следующим образом:
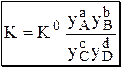
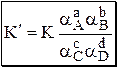
Для удобства многие константы равновесия разных типов имеют свои обозначения, например, Ka - константа кислотности, KSH - константа автопротолиза растворителя, KS - произведение растворимости.
Некоторые из равновесий, используемые в аналитической химии (протолитические равновесия с участием многоосновных кислот и многокислотных оснований, процессы комплексообразования), протекают ступенчато. Константы равновесия, характеризующие каждую ступень, называются ступенчатыми. Произведение ступенчатых констант называется общей константой равновесия. Общая константа не описывает реально существующего равновесия, но более удобна для расчётов. Например:
1 ступень Ag+ + NH3 › [Ag(NH3)]+
2 ступень [Ag(NH3)]+ + NH3 › [Ag(NH3)2]+
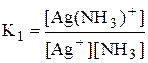
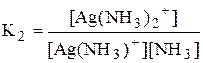
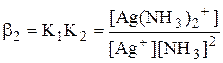
Часто вместо значений констант равновесия используют их десятичные логарифмы (если константа очень большая) или отрицательные десятичные логарифмы (если она, наоборот, значительно меньше единицы). Отрицательный десятичный логарифм константы равновесия называется показателем данной константы (рК).
3.5. Общие принципы расчёта состава равновесных систем
Для определения состава равновесной смеси при определённых условиях используют концентрационные константы равновесия, а также уравнения материального баланса и электронейтральности.
Уравнение материального баланса основано на том, что число атомов определённого элемента (или групп атомов определённого вида) в изолированной системе остаётся неизменным.
Например, для раствора, содержащего частицы Ag+, NH3, NH4+, Ag(NH3)+ и Ag(NH3)2+:
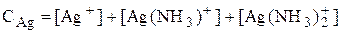
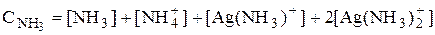
Уравнение электронейтральности основано на том, что в закрытой системе суммарное число отрицательных зарядов должно быть равно числу положительных.
Например, для водного раствора Na2S
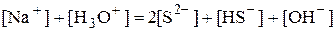
Уравнения материального баланса и электронейтральности выполнимы для равновесных концентраций частиц, но не для активностей. Для расчётов следует использовать концентрационные константы равновесия, а не термодинамические. При малых ионных силах значения концентрационных и термодинамических констант незначительно отличаются друг от друга, поэтому для характеристики равновесий в разбавленных растворах допустимо использование термодинамических констант, значения которых приведены в справочниках.
Равновесия можно описывать графически. Графики, представляющие собой зависимость молярных долей компонентов системы от параметра, влияющего на состояние системы, называются распределительными диаграммами. Графики, представляющие собой зависимость логарифмов равновесных концентраций компонентов системы от фактора, влияющего на равновесие, называются концентрационно-логарифмическими диаграммами (рис 3.2).
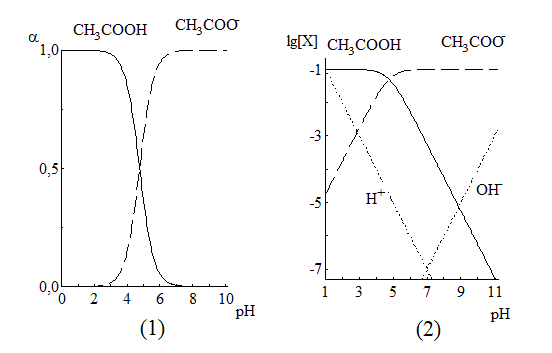
Рис. 3.2. Распределительная(1) и концентрационно-логарифмическая (2) диаграммы для уксусной кислоты
ГЛАВА 4
 |
