Модуль 1. Химическая термодинамика
Законы термодинамики и их применение к простейшим процессам. Первый закон термодинамики. Внутренняя энергия, энтальпия, теплота, работа. Работа и теплота как характеристики процесса. Взаимосвязь теплоты, работы и изменения внутренней энергии. Применение первого закона термодинамики к простейшим процессам. Тепловые эффекты и теплоты образования. Связь величины Qр и QV. Закон Гесса и его термодинамическое обоснование. Теплоемкость вещества. Зависимость теплоемкости вещества от температуры. Зависимость тепловых эффектов процессов от температуры. Вывод и анализ уравнения Кирхгофа. Расчеты тепловых эффектов химических реакций, теплоты агрегатных и фазовых превращений, теплоты растворения при различных температурах.
Второй закон термодинамики. Самопроизвольные и несамопроизвольные процессы. Энтропия. Приведенная теплота и энтропия для равновесных и неравновесных процессов. Изменение энтропии как критерия равновесия и направления процессов в изолированной системе. Вычисление изменения энтропии при охлаждении (нагревании) веществ и при фазовых переходах.
Третий закон термодинамики. Формулировки третьего закона термодинамики и следствия. Постулат Планка. Вычисление абсолютных стандартных величин энтропии вещества по термодинамическим данным. Энергия Гиббса, энергия Гельмгольца, химический потенциал. Физический смысл этих величин. Применение энергии Гиббса и энергии Гельмгольца в качестве критериев направленности процессов и равновесия в изотермических системах. Зависимость энергии Гиббса от температуры и давления.
Химическое равновесие. Динамическая и термодинамическая характеристика равновесия. Термодинамический закон действия масс. Константа равновесия. Способы выражения константы равновесия в гомогенных и гетерогенных системах. Вычисление состава равновесной системы, выхода продукта, степени превращения исходных веществ, степени диссоциации. Уравнения изобары и изохоры химической реакции. Уравнение изотермы и направление химической реакции. Константа равновесия и стандартное изменение энергии Гиббса. Расчет изменения энергии Гиббса и констант равновесия для различных температур, приближенные методы расчета константы равновесия.
Задание 1.1. Определение тепловых эффектов химических реакций
Вычислите тепловой эффект образования вещества А из простых веществ при температуре 298 К и стандартном давлении, если известна его энтальпия сгорания при этой температуре и стандартном давлении (табл. 1). При вычислении следует принять, что конечные продукты сгорания СО2(г), Н2О(ж), N2(г).
Теплоты сгорания простых веществ указаны в следующих уравнениях:
С(графит) + О2(г) = СО2(г) + 393,51 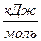 ;
;
Н2(г) + 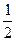 О2(г) = Н2О(ж) + 285,83
О2(г) = Н2О(ж) + 285,83 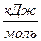 .
.
Таблица 1
| Номер варианта | Вещество А | Формула | Состояние | ∆Нсгор, 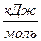 |
| Мочевина | СН4N2О | т | –632,20 | |
| Нитрометан | СН3NО2 | ж | –708,77 | |
| Ацетальдегид | С2Н4О | г | –1193,07 | |
| Этилацетат | С4Н8О2 | ж | –2246,39 | |
| Глицерин | С3Н8О3 | ж | –1661,05 | |
| Диметиламин | С2Н7N | ж | –1768,59 | |
| Ацетон | С3Н6О | ж | –1785, 73 | |
| Пентан | С5Н12 | г | –3536,15 | |
| Триметиламин | С3Н9N | г | –2442,92 | |
| Пропанол-1 | С3Н8О | ж | –2010,41 | |
| Бутан | С4Н10 | г | –2877,13 | |
| Амиловый спирт | С5Н12О | ж | –3320,84 | |
| Фенол | С6Н6О | т | –3063,52 | |
| Гидрохинон | С6Н6О2 | т | –2860,60 | |
| Анилин | С6Н7N | ж | –3396,20 | |
| Бензойная кислота | С7Н6О2 | т | –3226,70 | |
| Пиридин | С5Н5N | ж | –2755,16 | |
| Стеариновая кислота | С18Н36О2 | т | –11274,60 | |
| Толуол | С7Н8 | ж | –3947,94 | |
| Октан | С8Н18 | ж | –5470,58 | |
| Нафталин | С10Н8 | т | –5156,78 | |
| Гексан | С6Н14 | г | –4194,75 | |
| Изобутан | С4Н10 | г | –2868,76 | |
| Сахароза | С12Н22О11 | т | –5646,73 | |
| Уксусная кислота | С2Н4О2 | ж | –874,58 | |
| Камфора | С10Н16О | т | –5924,84 | |
| Бутанол | С4Н10О | ж | –2671,90 | |
| Формальдегид | СН2О | г | –561,07 | |
| Щавелевая кислота | С2Н2О4 | т | –251,88 | |
| Антрацен | С14Н10 | т | –7067,45 |
Задание 1.2. Определение возможности протекания химической реакции в стандартных и нестандартных условиях
Выполните следующие девять заданий для данной реакции (табл. 2) (справочные величины, необходимые для расчетов, возьмите в прил. 1).
1. По значениям стандартных энтальпий образования участвующих в реакции веществ DH0f,298, вычислите тепловой эффект реакции при стандартных условиях DH0298. Выделяется или поглощается тепло при протекании реакции? Эндо - или экзотермической является данная реакция?
2. Для исходных веществ и продуктов реакции определите величины средних теплоемкостей 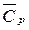 в диапазоне температур 298 – Т и изменение теплоемкости Δ
в диапазоне температур 298 – Т и изменение теплоемкости Δ 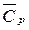 в ходе реакции. Пользуясь законом Кирхгофа вычислите тепловой эффект реакции DH0Т при температуре T и стандартном давлении с учетом величины Δ
в ходе реакции. Пользуясь законом Кирхгофа вычислите тепловой эффект реакции DH0Т при температуре T и стандартном давлении с учетом величины Δ 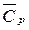 .
.
3. Выведите для реакции функциональную зависимость изменения молярной изобарной теплоемкости от температуры: DC0p = f(T).
4. Вычислите величину DH0Т, пользуясь законом Кирхгофа и установленной функциональной зависимостью DC0p = f (T). Как влияет увеличение температуры на величину теплового эффекта реакции?
5. Качественно оцените знак изменения энтропии DS при протекании реакции. Объясните полученный результат. По значениям стандартных энтропий участвующих в реакции веществ S0298 вычислите изменение энтропии реакции при стандартных условиях DS0298.
6. Используя функциональную зависимость DC0P = f (T) вычислите изменение энтропии реакции DS0T при температуре T и стандартном давлении. Как влияет повышение температуры на величину DS0T?
7. Качественнооцените вероятность самопроизвольного протекания реакции при высоких и низких температурах. Вычислите изменение энергии Гиббса DG0298 реакции, протекающей при стандартных условиях. Возможно ли самопроизвольное протекание процесса при стандартных условиях? Определите температуру T0, при которой реакция меняет свое направление.
8. Вычислите изменение энергии Гиббса DG0T реакции, протекающей при стандартном давлении и температуре T, считая, что DH0T и DS0T не зависят от температуры (метод Улиха). Постройте график зависимости DG0T от температуры. Сделайте вывод о влиянии температуры на вероятность самопроизвольного протекания процесса в прямом направлении.
9. Вычислите изменение энергии Гиббса DG0T реакции при температуре T и стандартном давлении, учитывая зависимость DH0T и DS0T от температуры. Сравните полученные значения DG0T с величиной изменения энергии Гиббса, рассчитанной по методу Улиха, и оцените их расхождение.
Таблица 2
| Номер варианта | Реакция | Т, К |
| 4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(г) | ||
| 4HCl(г) + O2(г) = 2Cl2(г) + 2H2O(г) | ||
| 2KOH(т) + CO2(г) = K2CO3(т) + H2O(г) | ||
| 2NaHCO3(т) = Na2CO3(т) + H2O(г) + CO2(г) | ||
| 2CuS(т) + 3O2(г) = 2CuO(т) + 2SO2(г) | ||
| Fe3O4(т) + 4H2(г) = 3Fe(т) + 4H2O(г) | ||
| 2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(г) | ||
| Mg(OH)2(т) = MgO(т) + H2O(г) | ||
| CS2(г) + 3O2(г) = CO2(г) + 2SO2(г) | ||
| MgCO3(т) = MgO(т) + CO2(г) | ||
| Fe2O3(т) + 3H2(г) = 2Fe(т) + 3H2O(г) | ||
| Ca(OH)2(т) + CO2(г) = CaCO3(т) + H2O(г) | ||
| BaO(т) + CO2(г) = BaCO3(т) | ||
| 4HBr(г) + O2(г) = 2Br2(г) + 2H2O(г) | ||
| 4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(г) | ||
| SnO2(т) + 2H2(г) = Sn(т) + 2H2O(г) | ||
| 4FeS2(т) + 11O2(г) = 2Fe2O3(т) + 8SO2(г) | ||
| 2H2S(г) + O2(г) = 2H2O(г) + S2(г) | ||
| FeO(т) + H2(г) = Fe(т) + H2O(г) | ||
| CaO(т) + H2O(г) = Ca(OH)2(т) | ||
| Al2O3(т) + 3SO3(г) = Al2(SO4)3(т) | ||
| 2NO(г) + O2(г) = 2NO2(г) | ||
| 2NiS(т) + 3O2(г) = 2NiO(т) + 2SO2(г) | ||
| TiO2(т) + 2H2(г) = Ti(т) + 2H2O(г) | ||
| PbO(т) + SO3(г) = PbSO4(т) | ||
| 4CO(г) + 2SO2(г) = 4CO2(г) + S2(г) | ||
| CO(г) + H2O(г) = CO2(г) + H2(г) | ||
| Fe2O3(т) + 3CO(г) = 2Fe(т) + 3CO2(г) | ||
| SnO2(т) + 2CO(г) = Sn(т) + 2CO2(г) | ||
| 2ZnS(т) + 3O2(г) = 2ZnO(т) + 2SO2(г) |
Задание 1.3. Химическое равновесие
Газообразные вещества А и Б реагируют с образованием газообразного вещества В (табл. 3).
Выполните следующие задания для данной реакции:
1. Выразите константы равновесия KP и KC через равновесное количество вещества В, равное x, если исходные вещества А и Б взяты в стехиометрических количествах при общем давлении в системе P и температуре T, К.
2. Рассчитайте KP и KC при 300 К, если Р = 7,5·104 Па, x = 0,45.
3. Вычислите равновесное количество вещества С при давлении в системе, равном 3·104 Па и температуре 300 К.
4. Рассчитайте степень превращения веществ А и Б при T = 300 К.
Таблица 3
| Номер варианта | Уравнение реакции | Номер варианта | Уравнение реакции |
| А + Б = 1/2В | 3/2А + Б = 3/2В | ||
| 1/2А + Б = В | А + 3Б = 3В | ||
| 3А + Б = 2В | 3А + Б = В | ||
| 2А + 3Б = 3В | А + 2Б = 2В | ||
| 2А + 1/2Б = 2В | 2А + 2Б = 1/2В | ||
| 3А + 1/2Б = В | А + Б = В | ||
| А + 2Б = В | 2А + 2Б = В | ||
| А + Б = 3В | 2А + 2Б = 3В | ||
| 1/2А + Б = 2В | 3А + 3Б = 2В | ||
| 1/2А + Б = 3В | 1/2А + Б = 1/2В | ||
| 2А + 1/2Б = 3В | 1/2А + 1/2Б = 2В | ||
| 2А + 3Б = 2В | А + Б = 3/2В | ||
| 3А + 1/2Б = 3В | 2А + 2Б = 3/2В | ||
| 3А + 1/2Б = 2В | 3/2А + 1/2Б = В | ||
| 1/2А + 1/2Б = 3В | 3/2А + Б = 3/2В |
Пример 1.1. Истинная молярная теплоемкость серебра в интервале температур от 273 до 1234 К выражается уравнением (см. прил. 1):
С0P = 23,97 + 5,27×10–3 Т – 0,25×105 Т –2 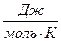 .
.
Вычислите среднюю молярную теплоемкость серебра 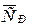 в интервале от 298 до 700 К.
в интервале от 298 до 700 К.
Решение. Среднюю теплоемкость в данном интервале температур рассчитывают по уравнению:
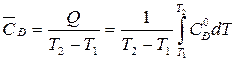 ,
,
где Q – количество теплоты, подведенной к системе.
С учетом зависимости истинной теплоемкости от температуры
СP = а + bT + c1 . T–2
получим выражение:
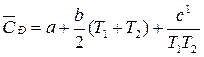 .
.
Подставляя коэффициенты a, b, c1 и температуру из условия задачи, получаем: 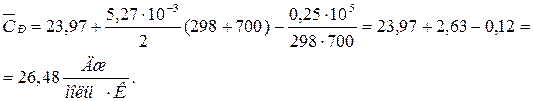
Пример 1.2.Определите энтальпию образования метана, если его энтальпия сгорания (DH0сгор.) равна –890,31 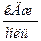 . Значения энтальпий сгорания водорода и углерода возьмите из термохимических уравнений:
. Значения энтальпий сгорания водорода и углерода возьмите из термохимических уравнений:
С(графит) + О2(г) = СО2(г) + 393,51 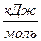 ;
;
Н2(г) + 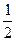 О2(г) = Н2О(ж) + 285,83
О2(г) = Н2О(ж) + 285,83 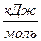 .
.
Решение. Запишем уравнение реакции образования одного моля метана:
С(графит) + 2H2(г) = CH4(г).
Тепловой эффект реакции равен
DH0 = ånDH0сгор. (исх.) – ånDH0сгор. (прод.).
DH0 = – 393,51 + 2∙(–285,83) – (–890,31) = –74,86 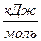 .
.
Пример 1.3. Выведите функциональную зависимость изменения молярной изобарной теплоемкости от температуры DC0Р = f(T) для реакции С(графит) + CO2(г) = 2CO(г). Вычислите тепловой эффект реакции при 500 К, если при стандартных условиях он равен 172,5 кДж.
Решение. Зависимость C0Р реагирующих веществ от температуры представлена для неорганических веществ уравнениями вида
C0Р = a + bT + c1T –2,
поэтому величину DC0Р рассчитывают по уравнению
D C0Р = Da + DbT +Dc1T –2 .
Выпишем температурные коэффициенты в уравнениях теплоемкости для веществ, участвующих в реакции (см. прил. 1).
| Вещество | Коэффициенты уравнения С0P = f (T), 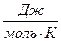 | ||
| а | b×103 | с1×10–5 | |
| С(графит) | 16,86 | 4,77 | –8,54 |
| СО (г) | 28,41 | 4,10 | –0,46 |
| СО2 (г) | 44,14 | 9,04 | –8,53 |
Вычислим их изменения:
Da = 2. 28,41 – 44,14 – 16,86 = -4,18;
Db = (2. 4,10 – 9,04 – 4,77).10–3 = -5,61.10–3;
Dc1 = [2. (–0,46) – (-8,53) – (-8,54)] .105 = 16,15.105.
Функциональная зависимость изменения молярной изобарной теплоемкости от температуры для данной реакции имеет вид:
DC0Р = -4,18 -5,61.10–3T + 16,15.105T –2 .
Для расчета теплового эффекта реакции воспользуемся уравнением Кирхгофа в интегральной форме:
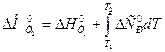 .
.
После подстановки зависимости D C0p от T в уравнение Кирхгофа и интегрирования получим:
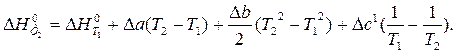
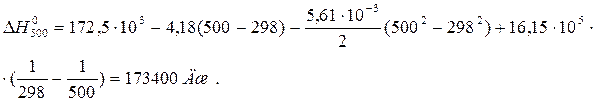
Пример 1.4. Изменение энтропии реакции С(графит) + CO2(г) = 2CO(г) при стандартных условиях ( 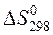 ) равно 175,46
) равно 175,46 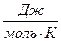 ). Используя функциональную зависимость теплоемкостей реагирующих веществ от температуры (см. пример 1.3), вычислите изменение энтропии при температуре 500 К (
). Используя функциональную зависимость теплоемкостей реагирующих веществ от температуры (см. пример 1.3), вычислите изменение энтропии при температуре 500 К ( 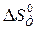 ).
).
Решение. Изменение энтропии реакции при заданной температуре находим по уравнению
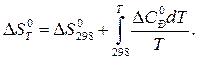
После подстановки DC0Р = Da + DbT +Dc1T –2 и интегрирования получим:
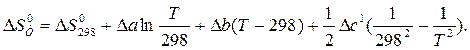
Значения Da, Db и Dc1 рассчитаны в примере 1.3. Отсюда:
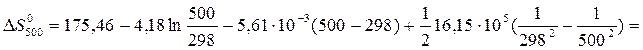 = 178,03
= 178,03  .
.
Пример 1.5.Константа равновесия KP газовой реакции А + Б = В равна 0,128·105 Па–1. Определите состав равновесной смеси (в мол. %), полученной при давлении Р = 10,13·105 Па из 2 моль вещества А и 1 моль вещества Б.
Решение. Обозначим через x равновесное количество вещества В. Так как на образование его должно израсходоваться согласно химическому уравнению реакции по x молей А и Б, то в равновесной смеси останется (2 – x) моль А и (1 – x) моль Б. Запишем количество вещества
| число молей: | А + Б = В | ||
| в исходной смеси | |||
| в равновесной смеси | (2 – x) | (1 – x) | x |
∑ ni = 2 – x + 1 – x + x = 3 – x.
Парциальные давления компонентов Pi рассчитываем по уравнению:
Pi = Xi·P,
где Xi – мольная доля i-го компонента газовой смеси, Xi = 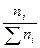 ;
;
P – общее давление в системе.
Выражения для парциальных давлений компонентов имеют вид:
PA = 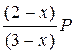 ; PБ =
; PБ = 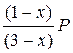 ; PВ =
; PВ = 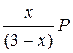 .
.
Подставим эти выражения в уравнение для константы равновесия реакции:
KP = 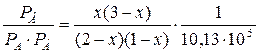 = 0,128·105 Па–1.
= 0,128·105 Па–1.
После небольших преобразований получим:
2,32 x2 – 6,96 x + 2,64 = 0.
Решая квадратное уравнение, находим x1 = 0,44 и x2 = 2,55.
Второй корень не имеет физического смысла, т.к. x может быть только меньше 1. Остается значение x = 0,44. Следовательно, в равновесной смеси содержится 2 – 0,44 = 1,56 моль А; 1 – 0,44 = 0,56 моль Б и 0,44 моль В. Состав смеси в мольных процентах определяется из соотношения
Xi = 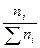 ·100%,
·100%,
где ∑ ni = 1,56 + 0,56 + 0,44 = 2,56.
Определим состав равновесной смеси:
XA = 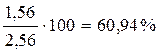 ;
;
XБ = 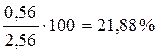 ;
;
XВ = 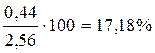 .
.
