Тип гибридизации и пространственная конфигурация молекул
| Тип молекулы, иона | Валентные орбитали | Пространственная конфигурация | Пространственное изображение | Примеры | Число гибридных орбиталей |
| АВ2 | p2 чистые | угловая | 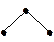 | H2S | |
| sp | линейная | 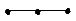 | BeF2 C2H2 | ||
| АВ3 | p3 чистые | пирамидальная | 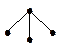 | PH3 | |
| sp2 | треугольная | 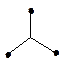 | BF3 CO32- | ||
| АВ4 | sp3 | тетраэдр | 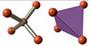 | CH4 CCl4 | |
| dsp2 | квадратная | 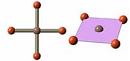 | [PdCl4]2- | ||
| АВ5 | sp3d | тригональная бипирамида | 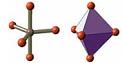 | PCl5 PF5 | |
| АВ6 | sp3d2 | октаэдр | 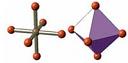 | SF6 |
Окончание таблицы 5
| АВ7 | sp3d3 | пентагональная бипирамида | 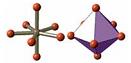 | IF7 | |
| АВ8 | sp3d4 | куб | 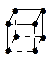 | [PdF8]4- |
Ионная связь образуется между элементами, резко различающимися по значениям их электроотрицательности.
Так, например, в молекуле NaCl ионная связь образуется не за счет общих электронных пар, а за счет передачи электрона более электроотрицательному атому и электростатического притяжения образующихся противоположно заряженных ионов, например, NaF:
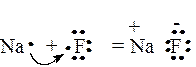
Схема 2. Схематическое изображение образования NaF
Свойства ионной связи
Ненаправленность.
Электрическое поле иона имеет сферический характер, следовательно, для ионной химической связи не характерна направленность.
Ненасыщаемость.
Ион способен взаимодействовать со многими соседними ионами противоположного знака, число которых зависит от зарядов ионов и соотношений геометрических размеров.
Ионная химическая связь проявляется в твердых веществах с ионной кристаллической решеткой.
Пример 13. Какой тип гибридизации атомных орбиталей бериллия (Be) осуществляется в молекуле фторида бериллия (BeF2)?
Дано: BeF2.
Найти: тип гибридизации в молекуле BeF2.
Решение: Электронная конфигурация атома бериллия в основном состоянии записывается как 1s22s2, то есть у атома отсутствуют неспаренные (валентные) орбитали:
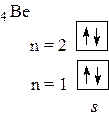
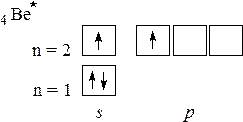
Химические связи может образовывать лишь атом, находящийся в возбужденном состоянии (Ве*) с конфигурацией 1s2 2s1 2p1 и имеющий по одному неспаренному электрону на 2s- и на 2p- орбиталях:
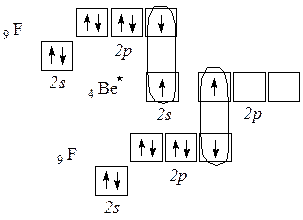
Электроны на этих двух орбиталях подвергаются гибридизации по sp-типу. Этот тип гибридизации дает линейную конфигурацию молекулы BeF2 (валентный угол 180º).
Ответ: Атомные орбитали Ве, участвующие в образовании молекулы находятся в состоянии sp-гибридизации.
Пример 14. Сера образует химические связи с калием, водородом, бромом и углеродом. Какие из связей наиболее и наименее полярны? Укажите, в сторону какого атома смещается общая электронная пара?
Дано: S, K, H, Br, C.
Найти: ∆χ(S – K), ∆χ(S - H), ∆χ(S – Br), ∆χ(S – C) - ?
Решение: Используя значения относительных электроотрицательностей атомов (Приложение 3 табл. 1), находим разность относительных электроотрицательностей (∆χ) серы и элемента, образующего с ней химическую связь:
а) ∆χ(S – K) = 2,6 – 0,91 = 1,69, электронная пара смещена в сторону атома серы;
б) ∆χ(S – H) = 2,6 – 2,1 = 0,5, электронная пара смещена в сторону атома серы;
в) ∆χ(S – Br) = 2,6 – 2,74 = -0,14, электронная пара смещена в сторону атома брома;
г) ∆χ(S – C) = 2,6 – 2,5 = 0,1, электронная пара смещена в сторону атома серы.
Чем больше по абсолютной величине разность относительных электроотрицательностей, тем более полярна связь. В данном примере наиболее полярной является связь сера – калий, наименее полярной – связь сера – углерод.
Ответ: Наиболее полярной является связь сера – калий, наименее полярной – связь сера – углерод. ∆χ(S – K) = 1,69 (электронная пара смещена в сторону атома серы); ∆χ(S – H) = 0,5 (электронная пара смещена в сторону атома серы); ∆χ(S – Br) = -0,14 (электронная пара смещена в сторону атома брома); ∆χ(S – C) = 0,1 (электронная пара смещена в сторону атома серы).
Пример 15.Длина диполя молекулы НСl равна 0,22∙10-8 см. Вычислите электрический момент диполя.
Дано: молекула HCl; l(H-Cl) = 0,22∙10-8 см= 2,2∙10-11 м; q = 1,60∙10-19 Кл.
Найти: μ молекулы НСl - ?
Решение:Электрический момент диполя рассчитывается по формуле:
μ = q∙l
μ = 1,60∙10-19 ∙2,2∙10-11 = 3,52∙10-30 Кл∙м = = 3,52∙10-30/(3,33∙10-30) = 1,06 D.
Ответ: Электрический момент диполя молекулы НСl равн 1,06 D.
