Химические свойства. При нагревании, а при повышении концентрации даже при комнатной температуре, бромная кислота разлагается:
При нагревании, а при повышении концентрации даже при комнатной температуре, бромная кислота разлагается:
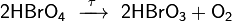
Бромная кислота является сильной одноосновной кислотой:

Бромная кислота — сильный (но медленный) окислитель:
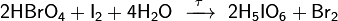
Йодная кислота НIО4 – бесцветное кристаллическое вещество,
выделяется обычно в виде кристаллогидрата НIО4 . 2Н2О. Йодная кислота
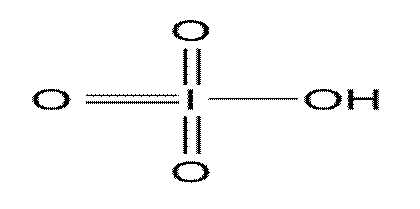
Н5IО6 ведет себя как пятиосновная кислота. Это слабая кислота (Кд1=5
поэтому при ее нейтрализации получают кислые(одно- и двухзамещенные) соли. Йодная кислота может существовать в виде различных гидратированных
соединений: х НIО4 .у Н2О
НIО4 : Н2О
1 0 НIО4 - метаиодная кислота
1 1 Н3IО5 - мезоиодная кислота
1 2 Н5IО6 - ортоиодная кислота
2 1 Н4I2О9 - двуиодная кислота (пироиодная кислота)
Соли всех этих кислот существуют
Получается действием H2SO4 на её соли:
5Ba(IO3)2 = Ba5(IO6)2 + 4I2 + 9O2;
Ba5(IO6)2 + 5H2SO4 = 5BaSO4↓ + 2H5IO6
В растворах периодатов имеют место равновесия:
(IO6)5− + 2H+ = (IO5)3− + H2O; (кислая среда
(IO5)3− + 2H+ = IO4− + H2O; кислая среда
2IO4− + H2O = (I2O9) 4− + 2H+ щелочная среда
В зависимости от условий (концентрация, рН) образуются соли, содержащие (IO6)5−, (IO5)3−, IO4−, (I2O9)4- орто-, мезо-, мета- и дипериодаты соответственно
Кислотные свойства НIO4 выражены несравненно слабее, чем у HClO4, в то время, как она проявляет более сильные окислительные свойства(E0(HIO4/HIO3) = 1,64 В.). Отвечающий ей ангидрид неизвестен. При нагревании НIO4разлагается по уравнению:
НIO4 → Н2О + I2O5 + О2
