Опыт 1. Ионные реакции с образованием осадков
Налить в три пробирки по 2…3 капли раствора хлорида бария и добавить в одну из них несколько капель раствора сульфата натрия, в другую – раствора серной кислоты, в третью – раствора сульфата аммония. Наблюдать появление одинакового осадка. Составить уравнение реакции. Что можно сказать о сущности реакций в проделанном опыте?
Опыт 2. Образование осадков и произведение растворимости
В две пробирки налить по 3…4 капли 0,005 М раствора нитрата свинца. В одну из них прибавить такой же объём 0,05 М раствора хлорида калия, а в другую – такой же объём 0,05 М раствора йодида калия. В какой из пробирок выпал осадок? Объяснить полученный результат, используя значения произведения растворимости. Составить уравнение реакций.
Опыт 3. Ионообменная реакция с образованием газа
В пробирку поместить кусочек мела (CaCO₃) и прибавить столько разбавленной соляной кислоты, чтобы весь мел погрузился в раствор. Наблюдать выделение газа. Составить уравнение реакции.
Опыт 4. Образование сульфидов железа и меди и их растворимость в соляной кислоте
В пробирку внести 2…3 капли раствора соли железа (II), в другую – 2…3 капли раствора соли меди (II). В каждую пробирку добавить несколько капель раствора сульфида аммония до появления осадков. Затем прилить к осадкам немного соляной кислоты. Какой из осадков растворяется? Составить уравнения реакций. Объяснить различие в растворимости осадков, используя значения произведения растворимости (см. приложение 2).
Опыт 5. Получение хромата бария
Внести в пробирку 2…3 капли раствора хлорида бария и 5…6 капель раствора ацетата натрия. Затем прибавить 4…6 капель раствора хромата калия. При этом выпадает жёлтый осадок хромата бария, не растворимый в уксусной кислоте. Составить уравнение реакции.
Опыт 6. Взаимодействие гидроксида магния с хлоридом аммония
В две пробирки внести по 2…3 капли раствора хлорида магния. В одну пробирку добавить 5…6 кристаллов хлорида аммония и, встряхивая, добиться их растворения. Затем в каждую из пробирок добавить по 8…10 капель раствора гидроксида аммония. Объяснить, почему осадок выпадает в пробирке, в которой отсутствует хлорид аммония (см. пояснения к опыту 4).
Контрольные вопросы и упражнения
1. Дать определение ионообменных реакций.
2. Написать в ионной форме следующие уравнения реакций:
Pb(NO₃)₂ + CaJ₂ →
CaCO₃ + HCl →
FeCl₃ + Ba(OH)₂ →
CH₃COOH + K₂CO₃ →
3. Как изменится растворимость осадка при добавлении одноимённого иона?
4. По ионным уравнениям составить уравнения в молекулярной форме
(анион - NO₃⁻, катион Na⁺)
2 Ag⁺ + CrO₄²⁻ = Ag₂CrO₄;
H⁺ + CH₃COO⁻ = CH₃COOH;
2 Al³⁺ + 3S²⁻ + 6 H₂O = 2 Al(OH)₃ + 3 H₂S.
Ионное произведение воды. Водородный показатель.
Гидролиз солей
Вода является слабым электролитом, который диссоциирует на ионы:
H₂O ⇄ H⁺ + OH⁻ или, точнее 2 H₂O ⇄ H₃O⁺ + OH⁻ .
Концентрация образующихся гидратированных ионов водорода и гидроксид-ионов невелика. При 22°C она составляет 10⁻⁷ моль/л.
Запишем выражение константы диссоциации воды
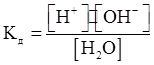 · (5)
· (5)
Учитывая, что концентрация воды мало меняется при диссоциации, [H₂O] можно считать постоянной величиной и включить в константу:
KВ = Kд · [H₂O] = [H⁺] · [OH⁻]. (6)
Это произведение называется ионным произведением воды. При 22°C эта константа равна 1·10⁻¹⁴
KВ = [H⁺] · [OH⁻] = 1·10⁻¹⁴. (7)
Ионное произведение воды – постоянная величина как для чистой воды, так и водных растворов различных электролитов, и она часто используется в аналитических расчётах.
Пример.Вычислите концентрацию [OH⁻] в 0,01 М бромистоводородной кислоты, приняв степень ее диссоциации за 100 %.
Решение. Уравнение диссоциации кислоты
HBr ⇄ H⁺ + Br⁻.
По формуле (3) рассчитываем концентрацию [OH⁻]
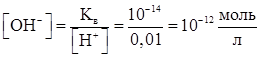 .
.
Водородный показатель. По кислотно-основным свойствам растворы обычно делят на кислые, нейтральные и щелочные. Это лишь качественная характеристика кислотности (основности) среды. Для количественной характеристики можно использовать молярную концентрацию ионов водорода. Удобно кислотность (основность) водных растворов выражать через десятичный логарифм концентрации ионов H+, взятый с обратным знаком. Эта величина называется водородным показателем, её обозначают символом pH:
pH = - lg[H⁺]. (8)
Если раствор нейтральный, т.е. [H⁺] = [OH-], то pH = 7. В кислом растворе [H⁺]>[OH⁻], следовательно, рН<7, в щелочном растворе [H⁺]<[OH⁻] и pH>7.
Пример. Считая диссоциацию гидроксида калия в воде полной, вычислите рН 0,001 М раствора KOH.
Решение.Определяем молекулярную концентрацию гидроксид-ионов в растворе
[OH⁻] = [KOH] · α · N(OH⁻),
где α - степень диссоциации; N(OH⁻) – число ионов (OH⁻), образующихся при разложении одной молекулы KOH.
[OH⁻] = 0,001·1·1 моль/л = 10⁻³ моль/л.
Используя ионное произведение воды, находим концентрацию иона водорода
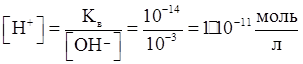 ,
,
а затем водородный показатель
pH = -lg[H+] = -lg(1·10⁻¹¹) = 11.
Значение pH растворов можно экспериментально определить при помощи кислотно-основных индикаторов – веществ, которые изменяют окраску в зависимости от концентрации водородных ионов.
Каждый индикатор характеризуется определёнными интервалами pH раствора, при которых он изменяет свой цвет. Изменение цвета лакмуса от красного до синего происходит при pH от 5 до 8, метилового оранжевого – от розового до жёлтого – при pH от 3,1 до 4,4, фенолфталеина – от бесцветного до малинового – при pH от 8,3 до 9,8. Эти интервалы значений pH называются областями перехода индикатора. Более точно pH раствора измеряется с помощью электрического прибора – pH-метра (потенциометра).
Изменение характера среды раствора происходит не только в результате добавления к воде кислоты или щёлочи, но и при растворении некоторых солей (гидролиза солей).
Гидролиз солей – химическое взаимодействие ионов солей с водой, во многих случаях сопровождающееся изменением реакционной среды (из нейтральной в кислую или щелочную).
Причина гидролиза лежит в том, что ионы соли с ионами воды образуют малодиссоциирующие комплексы (ионы или молекулы). Реакции гидролиза всегда направлены в сторону образования таких комплексов.
Если продукты гидролиза растворимы, то реакция имеет обратимый характер. Однако в результате гидролиза могут получаться летучие (газы) или малорастворимые вещества (осадки). В этом случае реакция становится необратимой.
Рассмотрим важнейшие случаи гидролиза солей.
1. Соль образована сильным основанием и слабой кислотой. Например, такие соли, как Na₂CO3, K₂S, Na₃PO₄, KCN и др.
KCN + H₂O ⇄ KOH + HCN ;
CN⁻ + HOH ⇄ HCN + OH⁻ .
Здесь KOH – сильное основание, хорошо диссоциирующее в воде, а HCN– слабая кислота, распадающаяся на ионы лишь в очень малой степени. Раствор приобретает щелочную реакцию вследствие наличия в нём свободных гидроксильных ионов, т.е. [OH⁻]>[H⁺] и pH>7.
Таким образом, водные растворы всех солей, образованных сильным основанием и слабой кислотой, характеризуются щелочной реакцией среды.
2. Соль образована слабым основанием и сильной кислотой. Например, NH₄Cl, AlCl₃, CuSO₄ и др.
В этом случае в процессе гидролиза главную роль играет катион соли. Анион же соли не связывает H⁺ ионов воды и практически в реакции гидролиза не участвует. Например
NH₄Cl + HOH ⇄ NH₄ОН+ HCl
или в ионном виде
NH₄⁺ + HOH ⇄NH₄OH + H⁺.
NH₄OH – основание слабое, малодиссоциирующее; HCl – кислота сильная, распадается на ионы в высокой степени. Вследствие этого в растворе [H⁺]>[OH⁻] и pH<7; раствор приобретает кислую реакцию.
3. Соль образована слабым основанием и слабой кислотой NH₄CN, Al₂S₃, (CH₃COO)₃Fe, CuS и т.д.
В этом случае в реакции гидролиза участвуют и катион (К+), и анион (А-) соли, они связывают ионы H+ и OH⁻ из молекулы воды:
КА + НОН ⇄ КОН + НА
K⁺ + A⁻ + HOH ⇄ KOH + AH.
Среда раствора может стать кислой (если основание, образовавшееся в результате гидролиза, является более слабым, чем кислота, т.е. константы диссоциации основания и кислоты отвечают соотношению Кдис(КОН)<Кдис(АН)), либо щелочной (если основание окажется более сильным, чем кислота, т.е. Кдис(КОН)>Кдис(АН)), либо будет нейтральной в случае равной силы кислоты и основания: Кдис(КОН)≈Кдис(АН). Например,
CH₃COONH₄ + HOH ⇄ CH₃COOH + NH₄OH.
Константы диссоциации уксусной кислоты (1,76 · 10⁻⁵) и гидроксида аммония (1,79 · 10⁻⁵) близки между собой. Поэтому pH раствора остаётся приблизительно равным 7.
Соли, которые образованы слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой подвергаются необратимому (полному) гидролизу. Такие соли не могут существовать в водных растворах. Например,
Al2S3 + 6 H2O ® 2 Al(OH)3¯ + 3 H2S;
Fe2(CO3)3 + 6 H2O ® 2 Fe(OH)3¯ + 3 H2 CO3 (CO2 + H2O);
(NH4)2SiO3 + 2 H2O ® 2 NH4OH (NH3 + H2O) + H2SiO3¯.
Полный гидролиз происходит также при совместном присутствии в водном растворе двух типов солей (соли, образованной слабым основанием и сильной кислотой, и соли, образованной сильным основанием и слабой кислотой). Например,
2 AlCl3 + 3 Na2 CO3 + 6 H2O ® 2 Al(OH)3¯ + 3 H2 CO3 (CO2 + H2O) + 6 NaCl.
4. Соли, образованные сильными основаниями и сильными кислотами, гидролизу не подвергаются, т.к. ионы не образуют слабых электролитов с водой.
Примеры таких солей: NaCl, KNO₃, BaCl₂, Na₂SO₄. Реакция в растворах таких солей практически нейтральна (pH = 7).
Соли, образованные многозарядным катионом или многозарядным анионом, гидролизуются ступенчато с образованием малодиссоциированных гидроксокатионов или гидроанионов. При комнатной температуре, как правило, гидролиз идёт по первой ступени.
I. Гидролиз по многозарядному катиону
Соль диссоциирует в растворе на ионы
CuSO₄ = Cu²⁺ + SO₄²⁻.
Первая ступень гидролиза Cu²⁺ + H₂O ⇄ CuOH⁺ + H⁺,
2 CuSO₄ + 2 H₂O ⇄ (CuOH)₂SO₄ + H₂SO₄.
Вторая ступень гидролиза CuOH⁺ + H₂O ⇄ Cu(OH)₂ + H⁺,
(CuOH)₂ SO₄ + 2 H₂O ⇄ 2 Cu(OH)₂ + H₂SO₄.
II. Гидролиз по многозарядному аниону
Соль диссоциирует в растворе на ионы
Na₃PO₄ = 3Na⁺ + PO₄³⁻.
Первая ступень гидролиза PO₄³⁻ + H₂O ⇄ HPO₄²⁻ + OH⁻,
Na₃PO₄ + H₂O ⇄ Na₂HPO₄ + NaOH.
Вторая ступень гидролиза HPO₄²⁻ + H₂O ⇄ H₂PO₄⁻ + OH⁻,
Na₂HPO₄ + H₂O ⇄ NaH₂PO₄ + NaOH.
Третья ступень гидролиза H₂PO₄⁻ + H₂O ⇄ H₃PO₄ + OH⁻,
NaH₂PO₄ + H₂O ⇄ H₃PO₄ + NaOH.
Полнота гидролиза характеризуется степенью гидролиза, которая показывает отношение числа гидролизованных молекул к общему числу растворенных молекул.
Лабораторная работа
Гидролиз солей
Цель работы
Изучение реакций гидролиза солей различных типов и смещения гидролитического равновесия.
Оборудование и реактивы
Штатив с пробирками. Пробиркодержатель. Чашка Петри. Спиртовка. Растворы (0,001-1 М): щёлочи, соляной кислоты, хлорида магния, сульфата меди, хлорида натрия, ацетата натрия, хлорида алюминия. Индикаторы: метиловый оранжевый, фенолфталеин, универсальная индикаторная бумага.
