Кинетика ферментативных реакций. Кинетика ферментативных реакций изучает скорости катализируемых ферментами реакций и влияние на них различных факторов
Кинетика ферментативных реакций изучает скорости катализируемых ферментами реакций и влияние на них различных факторов.
В простейшем случае ферментативную реакцию можно представить как двухстадийный процесс. К настоящему времени многочисленными экспериментами показано, что первая стадия - это образование фермент-субстратного комплекса (ЕS).Вторая стадия - это превращение фермент-субстратного комплекса через ряд промежуточных состояний в комплекс фермент-продукт и распад этого комплекса на свободный фермент и продукт реакции. Наиболее коротким схематическим способом записи этих стадий является:
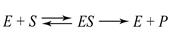
Зависимость скорости реакции v от концентрации субстрата Сs описывается уравнением Михаэлиса-Ментен, где Км (константа Михаэлиса), а Vмакс (max) - максимальная скорость ферментативной реакции при полном насыщении фермента субстратом:
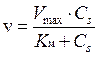
Графически зависимость скорости реакции от концентрации субстрата представляет полуветвь гиперболы (рис.5):
Рис. 5. Зависимость скорости реакции от концентрации субстрата.
При полном насыщении фермента субстратом наблюдается ситуация, когда Cs >> Kм, тогда значением Км в знаменателе можно пренебречь, и скорость реакции становится максимальной:
v = Vмакс
На графике (рис.5) при этом наблюдается плато при высоких концентрациях субстрата.
При полунасыщении фермента субстратом v = Vмакс/2. Подстановка этого значения скорости в уравнение Михаэлиса приводит к значению Км = Cs. Поэтому можно дать следующее определение Км: константа Михаэлиса - это концентрация субстрата, при которой скорость ферментативной реакции равна половине максимальной скорости.
Поскольку в ходе ферментативной реакции наблюдается расходование субстрата и накопление продукта, зависимость их концентраций от времени можно выразить следующим образом (рис. 7):
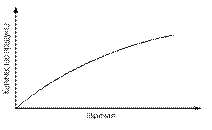
Рис. 7. Графики зависимости концентрации субстрата и продукта ферментативной реакции от времени.
Для более удобного графического представления экспериментальных данных Г. Лайнуивер и Д. Бэрк предложили использовать двойные обратные величины 1/v и 1/Cs, поскольку если существует равенство между двумя какими-либо величинами, то и обратные величины также равны.
Если построить график зависимости 1/v от 1/Сs, получится прямая линия, отсекающая на оси ординат отрезок 1/Vмакс, а на оси абсцисс – отрезок, равный -1/Км.
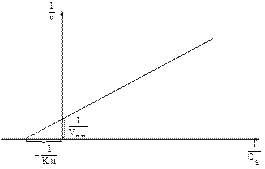
Рис. 8. График зависимости скорости реакции от концентрации субстрата, представленный в двойных обратных координатах.
Ингибирование ферментов
Все типы ингибирования ферментов можно разделить на две большие группы: необратимое и обратимое ингибирование. Необратимые ингибиторыпрочно связываются с молекулой фермента, и после удаления ингибитора (например, с помощью диализа), активность фермента не восстанавливается. Наиболее известными необратимыми ингибиторами являются фосфорорганические яды, применяемые в качестве инсектицидов и как боевые отравляющие вещества, цианиды и ионы тяжелых металлов, например, ртути, кадмия, меди, свинца, связывающиеся с карбоксильными и сульфгидрильными (- SH) группами в белках.
Обратимые ингибиторыотделяются от комплекса фермента с ингибитором при понижении их концентрации, и фермент восстанавливает свою каталитическую активность. По типу воздействия на зависимость ферментативной реакции от концентрации субстрата обратимые ингибиторы делятся на конкурентные, неконкурентные, безконкурентные и смешанные.
Конкурентные ингибиторыявляются структурными аналогами субстрата и связываются в активном центре фермента, конкурируя с субстратом за место связывания. Они вызывают увеличение (ухудшение) константы Михаэлиса, но не влияют на максимальную скорость реакции (рис.9)
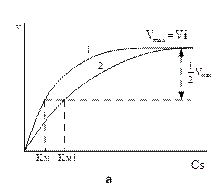
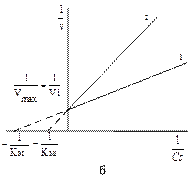
Рис. 9. Зависимость скорости ферментативной реакции от концентрации субстрата в присутствии конкурентного ингибитора (а) и ее представление в двойных обратных координатах (б). Где 1 – график без ингибитора, 2 - график с ингибитором. Vi – Vмах в присутствии ингибитора.
Неконкурентное ингибирование наблюдается, если ингибитор связывается вне активного центра. К неконкурентным ингибиторам относятся, например, тиоловые яды.
Неконкурентные ингибиторы не влияют на константу Михаэлиса, но уменьшают максимальную скорость ферментативной реакции (рис.8):
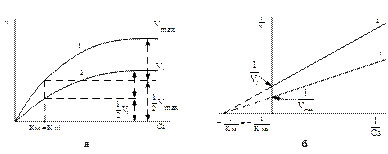 Рис. 10. Зависимость скорости ферментативной реакции от концентрации субстрата в присутствии неконкурентного ингибитора. Обозначения как на рисунке 9.
Рис. 10. Зависимость скорости ферментативной реакции от концентрации субстрата в присутствии неконкурентного ингибитора. Обозначения как на рисунке 9.
Бесконкурентное ингибирование -ингибитор связывается только с фермент-субстратным комплексом, но не со свободным ферментом, изменяя его конформацию, что затрудняет катализ. Максимальная скорость реакции и константа Михаэлиса уменьшаются в одинаковое количество раз и на графике в двойных обратных координатах наблюдаются параллельные прямые (рис.11).
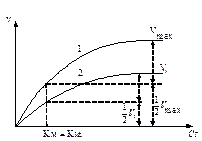
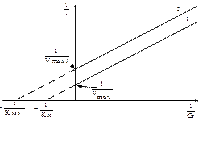 Рис. 11. Зависимость скорости ферментативной реакции от концентрации субстрата в присутствии бесконкурентного ингибитора.
Рис. 11. Зависимость скорости ферментативной реакции от концентрации субстрата в присутствии бесконкурентного ингибитора.
Смешанное ингибирование встречается, если ингибитор связывается как в активном центре, так и вне его, а комплекс ЕI сохраняет частичную активность по сравнению с нативным ферментом. Такие ингибиторы увеличивают константу Михаэлиса и уменьшают максимальную скорость ферментативной реакции. В двойных обратных координатах ситуация выглядит так (рис.12):
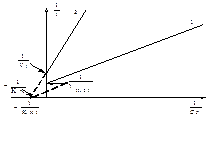
Рис.12. Представление зависимости скорости ферментативной реакции от концентрации субстрата в присутствии смешанного ингибитора в двойных обратных координатах.
Типы обратимого ингибирования ферментов представлены в таблице.
| Тип ингибитора: | Механизм действия: |
| КОНКУРЕНТНОЕ | I связывается в активном центре и конкурирует с субстратом. Vi max = V max ; Км i > Км |
| НЕКОНКУРЕНТНОЕ | I связывается вне активного центра. Vi max < V max ; Км i = Км |
| БЕСКОНКУРЕНТНОЕ | I связывается не с Е, а с комплексом ЕS. Vi max / Км i = Vmax / Км |
| СМЕШАННОЕ | I связывается в активном центре и вне его. Vmax и Км уменьшаются независимо друг от друга. |
Классификация ферментов
Стремительное развитие энзимологии в 20 веке привело к тому, что остро встала проблема разработки единой классификации и унификации названий ферментов. В 1961 г. на V Международном биохимическом конгрессе в Москве была утверждена современная классификация ферментов, в основе которой лежит их разделение на шесть классов в зависимости от типа катализируемой реакции.
1) Оксидоредуктазыкатализируют окислительно-восстановительные реакции.
Пример: исп.

В большинстве случаев дегидрогеназы катализируют обратимые реакции
2) Трансферазыкатализируют реакции межмолекулярного переноса различных групп атомов,
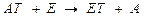
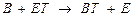
где Т - транспортируемая группа,
АТ – субстрат – донор,
В – субстрат - акцептор транспортируемой группы.
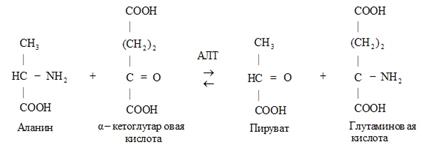
Пример 1 – аминотрансферазы, переносят альфа-аминогруппу аминокислот на место альфа-кетогруппы в кетокислотах. На схеме АЛТ – аланинаминотрансфераза.
Пример 2 - один из наиболее распространённых видов посттрансляционной модификации белка (синтез фосфопротеинов) — фосфорилирование, которое катализируют фосфотрансферазы (киназы), осуществляющие перенос фосфатной группы от молекулы аденозинтрифосфата (АТФ) на различные субстраты.
3) Гидролазы катализируют расщепление внутримолекулярных связей с присоединением воды по разорванной связи:
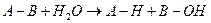 ,где А-В - субстрат
,где А-В - субстрат
В качестве примеров гидролаз можно привести протеиназы, катализирующие расщепление белков и пептидов; эстеразы, гидролизующие сложноэфирные связи, гликозидазы, разрывающие гликозидные связи с присоединением воды. Все пищеварительные ферменты относятся к классу гидролаз (некоторые из них: пепсин, трипсин, химотрипсин, амилаза, липаза, рибонуклеаза).
4) Лиазыкатализируют разрыв и синтез связей С-О, С-N, С-C, а также обратимые реакции негидролитического отщепления групп с образованием двойной связи.
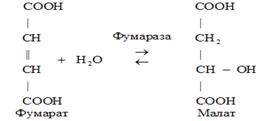
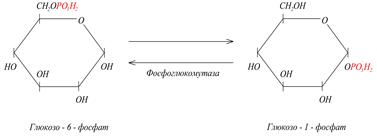
5) Изомеразы. К классу изомераз относят ферменты, катализирующие обратимые взаимопревращения изомеров. В качестве примера приведем следующую реакцию:
6) Лигазы (синтетазы) катализируют реакции синтеза различных веществ с использованием энергии АТФ или других макроэргических молекул. В качестве примера можно привести синтез карбамоилфосфата.

На основании приведенной системы классификации ферментов (КФ) был издан список ферментов, где каждому ферменту присвоен четырехзначный номер (номенклатура ферментов). Первая цифра номера указывает на принадлежность фермента к одному из шести классов. В пределах классов ферменты группируются в подклассы и подподклассы в соответствии с особенностями катализируемых реакций, четвертое число — порядковый номер фермента в его подподклассе.
Например, кислая фосфатаза имеет шифр 3.1.3.2; это означает, что она относится к классу гидролаз (3.), подклассу этих ферментов, действующих на сложноэфирные связи (3.1.), к подподклассу ферментов, гидролизующих моноэфиры фосфорной кислоты (3.1.3.), а порядковый номер фермента в данном подподклассе — 2 (3.1.3.2).
