Тема 1.3. определение активности ферментов. исследование кинетики ферментативного катализа и влияния активаторов и ингибиторов
Актуальность темы
Знания механизмов, посредством которых клетки и целые организмы координируют и регулируют весь набор метаболических процессов, важны при исследованиях в разных областях биомедицинских наук. Сюда можно отнести проблемы карцерогенеза, сердечно – сосудистых заболеваний, старения, действия гормонов и лекарственных препаратов. Во всех этих областях наблюдаются примеры нарушения регуляции работы ферментов, имеющие важное медицинское значение. Из всех факторов, от которых зависит активность фермента - концентрация фермента и субстрата, температура, рН и присутствие ингибиторов, - наибольший клинический интерес представляют два последних.
Активаторы и ингибиторы влияют на активный центр фермента, способствуют формированию его или блокированию. Они могут взаимодействовать с аллостерическим центром и тем самым менять ферментативную активность. Ингибиторами нередко являются продукты промежуточных или конечных реакций какого-либо биохимического процесса. Некоторые природные или синтетические вещества оказывают избирательное ингибирующее действие на ферменты и используются в качестве лекарственных веществ. В больших дозах подобные вещества могут оказаться ядами.
Большинство лекарственных препаратов оказывает свое действие, влияя на соответствующие ферментативные реакции. Многие такие препараты сходны с природными субстратами и потому могут действовать как конкурентные ингибиторы ферментов. Чтобы понять многие процессы, которые существенны для фармакологии и токсикологии, необходимо иметь четкое представление о механизмах ингибирования ферментов.
Теперь ознакомьтесь с целями занятия.
Общая цель
Уметь использовать знания о механизмах регуляции активности ферментов при изучении состояния обмена веществ, а также для обоснования использования препаратов, действующих по принципу ферментативных ингибиторов или активаторов.
Конкретные цели: Цели исходного уровня:
Уметь:
| 1. Интерпретировать основные этапы ферментативного катализа. | 1.Интерпретировать данные о катализе и катализаторах (каф. медицинской и фарм. химии). |
| 2. Дать характеристику основным типам ингибиторов. | |
| 3. Объяснить основные механизмы регуля- ции каталитической активности ферментов. | |
| 4. Определить класс ферментов, основы- ваясь на типе катализируемой реакции. | 2.Интерпретировать и приводить примеры различных типов химических реакций (каф. медицинской и фарм. химии). |
Задания для самопроверки и самокоррекции исходного уровня знаний
Задание 1. Известно, что скорость взаимодействия веществ А и В увеличилась в три раза после добавления вещества К. В качестве конечных продуктов обнаруживается вещество АВК. Является ли вещество К катализатором?
А. Да
В. Нет
Задание 2. В эксперименте установили, что окисление SО2 в SО3 с участием катализатора NО происходит в 100 раз быстрее, чем не катализируемая реакция. Укажите причину изменения скорости реакции:
А. Понижение свободной энергии реакции
В. Понижение энергии активации реакции присутствии катализатора
С. Повышение энергии активации реакции в присутствии катализатора
D. Изменение степени ионизации реагирующих веществ
Е. Изменение кинетической энергии исходных и конечных продуктов
Задание 3.При интенсивной мышечной работе в скелетной мускулатуре накапливается молочная кислота, по следующей реакции:
СН3- С -СООН ↔ СН3-СН-СООН
|| |
О ОН
К какому типу относится приведенная реакция?
А. Окислительно-восстановительная реакция
В. Реакция гидролиза
С. Реакция обмена
D. Реакция электролиза
Е. Реакция синтеза
Задание 4. Вещество А и В взаимодействует по схеме А + В « АВ. При заданной концентрации А и В через 30 минут устанавливается подвижное равновесие, т.е. скорость пямой и обратной реакции уравниваются. Какую из приведенных характеристик реакции изменит внесение катализатора?
А. Скорость прямой реакции
В. Константу равновесия
С. Скорость обратной реакции
D. Время наступления равновесия
Е. Концентрацию продуктов реакции
Правильность решения проверьте, сопоставив их с эталонами ответов.
Эталоны ответов к решению заданий для самопроверки и самоконтроля исходного уровня
2. – В, 4. – D.
Информацию для восполнения исходных знаний можно найти в следующей литературе:
1.Тюкавкина Н.А.,Бауков Ю.И. Биоорганическая химия. –М.: Медицина, 1991. – С.88 -
95.
2.Лекции по биоорганической химии.
Содержание обучения
Содержание обучения должно обеспечивать достижение целей обучения, чему способствует граф логической структуры изучаемой темы (Приложение 1).
Основные теоретические вопросы, позволяющие выполнить целевые виды деятельности:
1.Основные положения теории ферментативного катализа.
2.Активаторы и ингибиторы ферментов и их использование в качестве лекарственных препараторов.
3.Регуляция активности ферментов. Примеры аллостерических ингибиторов и активаторов.
4.Классификация ферментов.
Найти материал для освоения этих вопросов можно в одном из следующих источников:
Обязательная литература
1.Губський Ю.Г. Біологічна хімія.- Київ-Тернопіль:Укрмедкнига, 2000.-С.88-89, 98-112
2.Тестовые задания по биологической химии/ Под ред.Б.Г.Борзенко.-Донецк,2000.-С.5-24
3. Лекции по биохимии.
4. Граф логической структуры (Приложение 1).
5. Инструкция к практическому занятию
Дополнительная литература
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия.-М.: Медицина, 1998.-С.129-165
2. Березов Т.Т., Коровкин Б.Ф. Биологическая химия.-М.: “Медицина”,1990.-С.105-112,
115-124, 126-128.
3. Николаев А.Я. Биологическая химия. -М.: ООО «Медицинское информационное агентство»,
1998.-С.70-81, 84-89
4. Кушманова О.Д., Ивченко Г.М. Руководство к лабораторным занятиям по биохимии.-
М.: Медицина, 1983. - С.69-70
После изучения вышеперечисленных вопросов для самопроверки усвоения материала по изучаемой теме Вам предлагается решить целевые обучающие задачи.
Целевые обучающие задачи
Задача 1. Ферментативный гидролиз жиров протекает в сто раз быстрее неферментативного процесса за счет образования промежуточного фермент-субстратного комплекса. Какие связи стабилизирует этот комплекс?
А. Прочные ковалентные
В. Ионные
С. Пептидные
D. N -гликозидные
Е. Сложноэфирные
Задача 2.Методом ИК-спектроскопии изучали природу связей между субстратом и связывающим участком активного центра фермента. В чем заключается взаимодействие фермента и субстрата по Кошленду?
А. Изменяется только конфигурация активного центра фермента
В. Изменяется только конфигурация молекулы субстрата
С. В молекуле фермента изменяется конфигурация аллостерического
центра под действием субстрата
D. При образовании фермент-субстратного комплекса в ферменте и
субстрате одинаково изменяется напряжение химических связей
Е. Активный центр подходит к субстрату, как ключ к замку
Задача 3. Лекарственные препараты на основе салицилатов являются обратимыми не конкурентными ингибиторами фермента глутаматдегидрогеназы. Предложите метод, который можно использовать для снижения степени ингибирования:
А. Увеличить концентрацию субстрата
В. Снизить концентрацию ингибитора
С. Изменить значение рН среды
D. Ввести структурный аналог субстрата
Е. Снизить концентрацию субстрата.
Задача 4. Больной С., 42 лет, после приема внутрь 20 мл метанола доставлен в клинику в тяжелом состоянии. Больному назначено внутривенно этиловый спирт в количестве, которое у здорового человека вызывает интоксикацию. Объясните, почему такое лечение оказывается эффективным, учитывая, что высокая токсичность метанола обусловлена действием продукта его метаболизма формальдегида, образующегося в печени под действием алькогольдегидрогеназы.
А. Этанол – конкурентный ингибитор алькогольдегидрогеназы
В. Этанол вызывает денатурацию фермента
С. Вследствие изменения рН среды
D. Происходит частичный протеолиз молекулы фермента
Е. Этанол связывает формальдегид.
Задача 5. При лечении опухолей мочеполовой системы в клинике применяется препарат метотрексат, обратимый конкурентный ингибитор дегидрофолатредуктазы, катализирующий синтез тетрагидрофолиевой кислоты. На взаимодействии с каким компонентом основан механизм действия этого препарата?
А. Апоферментом
В. Активным центром фермента
С. Аллостерическим центром фермента
D. Простетической группой
Е. Субстратом
Задача 6.Кроме Н+ и углекислого газа связывание кислорода гемоглобином регулируется бисфосфоглицератом, который присоединяется к белку в участках, пространственно удаленных от гема. Как называется такой вид регуляции?
А. Регуляция по принципу обратной связи
В. Частичный протеолиз молекулы фермента
С. Присоединение или отщепление белка-регулятора
D. Присоединение или отщепление низкомолекулярного эффектора (модулятора)
Е. Фосфорилирование молекулы
Задача 7.В клетках Е. соli синтез пиримидиновых нуклеотидов осуществляется по схеме метаболического пути: СО2+ NН3+2АТФ→ Р1→Р2→УТФ→ЦТФ. Конечный продукт является эффектором для фермента, катализирующего первую реакцию. При увеличении в клетке концентрации ЦТФ синтез пиримидиновых нуклеотидов прекращается. Какой вид регуляции описан?
А. Аллостерическая регуляция
В. Частичный протеолиз
С. Фосфорилирование молекулы фермента
D. Присоединение белков ингибиторов
Е. Отщепление белков ингибиторов
Задача 8. При панкреатитах нарушается переваривание жиров в желудочно-кишечном тракте, вследствие снижения активности панкреатической липазы, катализирующей гидролиз жиров. К какому классу относится этот фермент.
А. Оксидоредуктазы
В. Трансферазы
С. Гидролазы
D. Лиазы
Е. Изомеразы.
Задача 9.При обследовании больного установлено повышение в крови активности изоферментов креатинкиназы ММ1 и ММ3. К какому классу относится этот фермент?
А. Оксидоредуктазы
В. Трансферазы
С. Лиазы
D. Гидролазы
Е. Изомеразы
Правильность решения проверьте, сопоставив их с эталонами ответов.
Эталоны ответов к решению целевых обучающих задач:
3 – В, 4 – А, 5 – В, 7 – А.
Инструкция к практическому занятию: “ Определение активности ферментов, исследование кинетики ферментативного катализа и влияния активаторов и ингибиторов“
Принцип работы:
Активаторы действуют на пространственную конфигурацию белковых молекул, помогая формированию активного центра и, тем самым, активируют фермент. В отличие от коферментов они не принимают непосредственного участия в реакции.
Активаторы некоторых ферментов : для амилазы слюны - хлорид натрия (NaCL), для пепсина- ионы водорода хлористоводородной кислоты, для липазы- желчные кислоты, для аденозинтрифосфатазы - ионы магния и марганца.
Ингибиторы также влияют на активный центр фермента, но при этом снижают каталитическую активность фермента. Нередко они являются конечными продуктами реакций какого либо биохимического процесса. Действие ингибиторов специфично для определенных ферментов или групп ферментов.
Материальное обеспечение: пробирки, 1% раствор крахмала, амилаза, 1% раствор NaCL, 1% раствор CuSO 4 , реактив Люголя
Работа 1.
Ход работы:
Разводят 1 мл слюны в 10 раз. В три пробирки наливают по 1 мл предварительно разведенной слюны. По предложенной ниже схеме ставят опыт:
№№ Фермент Субстрат Исследуемое Количество
(амилаза), слюна (р-р крахмала) соединение разв. 1:10

1. 1мл 1мл дист.вода 0,5мл
2. 1мл 1мл 1% NaCL 0,5мл
 3. 1мл 1мл 1% CuSO 4 0,5мл
3. 1мл 1мл 1% CuSO 4 0,5мл
1. Все пробирки инкубируют 10 минут при температуре 25 градусов.
2. Определяют влияние исследуемых соединений на каталитическую функцию амилазы. Для этого проводят качественную реакцию на крахмал (субстрат). Во все пробирки добавляют по 1 капле реактива Люголя, содержащего йод, перемешивают, наблюдают окраску и определяют, в какой пробирке действует активатор или ингибитор. Целесообразно в каждую пробирку добавить до 2 мл дист. воды и перемешать. Окраска будет более наглядной.
ВЫВОДЫ:
Работа 2. Выполните лабораторную работу по индивидуальному заданию, полученному у преподавателя.
ВЫВОДЫ:
Подпись преподавателя:
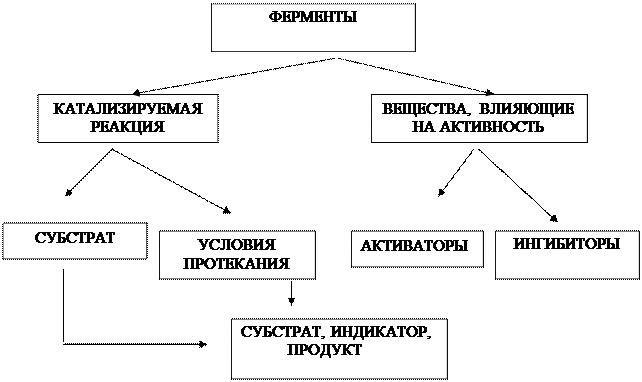
Приложение 1
Граф логической структуры
 |
ТЕМА 1.4. ИССЛЕДОВАНИЕ РОЛИ КОФАКТОРОВ И КОФЕРМЕНТНЫХ ФОРМ ВИТАМИНОВ В КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ ФЕРМЕНТОВ
Актуальность темы
Значение витаминов для нормальной жизнедеятельности организма не вызывает сомнений. Витамины являются составным компонентом сложных ферментов, образуя небелковую часть фермента – кофермент. Без кофермента сложный фермент не может функционировать, т.к кофермент, как правило, непосредственно контактирует с субстратом и является переносчиком электронов, атомов или групп атомов (аминогрупп, метильных групп и др.), тем самым участвуя в катализе определенных типов метаболических реакций. Знание коферментной функции витаминов необходимо для последующего изучения метаболизма органов и тканей в курсе биохимии, а также при изучении фармакологии, клинических и гигиенических дисциплин.Теперь ознакомьтесь с целями занятия.
Общая цель
Уметь обосновать биологическую функцию витаминов как структурных компонентов ферментов для использования на последующих кафедрах при объяснении нарушений метаболизма и их клинических проявлений при недостатке (избытке) витаминов в организме, а также для понимания принципов применения антивитаминов в лечебной практике.
. Конкретные цели: Цели исходного уровня:
Уметь:
| 1.Интерпретировать структуру витаминов и их коферментных форм. | 1.Интерпретировать структуру мононуклеотидов, сложных эфиров (каф. медицинской и фармацевтической химии). |
| 2.Анализировать причины нарушения синтеза коферментов. | 2. Интерпретировать принцип метода определения пирувата в биологических жидкостях (каф. медицинской и фармацевтической химии). |
| 3.Анализировать роль витаминов в обменных реакциях. | 3. Интерпретировать принцип метода определения лактата в биологических жидкостях(кафедра медицинской и фармацевтической химии). |
| 4.Интерпретировать метаболические нару- шения при отсутствии витаминов. | |
| 5.Интерпретировать конкурентное действие антивитаминов. |
Для проверки исходного уровня Вам предлагается выполнить ряд заданий.
