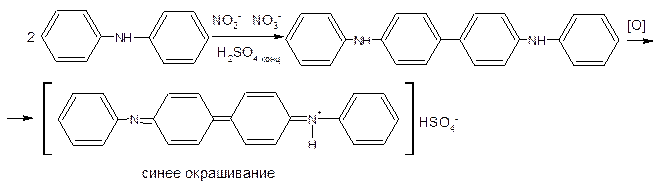Йодид-ион
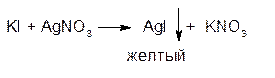 1. ГФ Растворы йодидов образуют с серебра нитратом желтый творожистый осадок:
1. ГФ Растворы йодидов образуют с серебра нитратом желтый творожистый осадок:
Осадок нерастворим в растворах азотной кислоты и аммиака, растворим в растворе тиосультфата натрия.
2.ГФ Йодиды легко окисляются, являясь восстановителями. Под действием слабых окислителей выделяется йод, сильные окислители могут окислить выделившийся йод далее до бесцветных гипойодидов или йодатов (IO-, IO3-).
Поэтому в реакции окисления йодидов до йода очень важен выбор окислителя и его концентрация. ГФ рекомендует для этой цели два реактива – раствор хлорида железа (III) или раствор натрия нитрита:
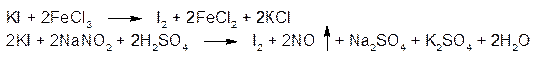
Выделяющийся йод извлекают хлороформом, слой хлороформа окрашивается в фиолетовый цвет.
3. ГФ При нагревании 0,1 г лекарственного средства с 1 мл серной кисло-
ты концентрированной выделяются пары фиолетового цвета.
2 I- + H2SO4 → SO32- + I2↑ + H2O
2. Сульфат-ион (SO42-)
ГФ Сульфаты с раствором бария хлорида образуют белый осадок бария сульфата:
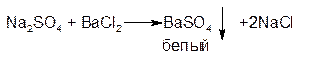
Осадок нерастворим в растворах минеральных кислот и щелочей.
3. Карбонат (гидрокарбонат) – ионы (СО32-, HCO3-)
1. ГФ При действии на карбонат-ион или гидрокарбонат-ион разведенных минеральных кислот появляются пузырьки диоксида углерода вследствие разложения выделяющейся нестойкой угольной кислоты (реакция вытеснения слабой угольной кислоты из соли сильной минеральной кислотой):
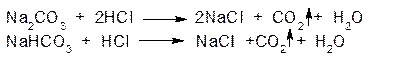
2. ГФ Реакция среды. Растворы карбонатов окрашивают фенолфталеин в ярко розовый цвет, гидрокарбонатов – остаются бесцветными.
3. ГФ Растворы карбонатов с насыщенным раствором магния сульфата образуют белый осадок в виде комплексной соли.; гидрокарбонаты образуют белый осадок только при нагревании, т. к. при этом они переходят в карбонаты.
4Na2СO3 + 4MgSO4 + 4 H2О → 3Mg СO3 · Mg (OН) 2 ·3H2О↓ + 2Na2 SO4 +
2Na2 HСO3 to → Na2СO3 + СO2↑ + H2О
4. Нитраты и нитриты (NO3-, NO2-)
1. ГФ (общая) Нитраты и нитриты образуют синее окрашивание с раствором дифениламина в концентрированной серной кислоте (pеакция окислительния дифениламина до дифенилбензидинвиолета):