Смещение химического равновесия
- это процесс изменения равновесного состава системы вследствие изменения внешних условий и установление нового равновесного состава.
Направление смещения равновесия подчиняетсяпринципу Ле Шателье:
Если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-либо из условий, определяющих состояние равновесия, то равновесие смещается в сторону уменьшения эффекта внешнего воздействия.
Вывести систему из состояния равновесия можно изменяя:
· а) температуру,
· б) общее давление
· в) парциальные давления газообразных реагентов или концентрации (активности) реагентов в растворах.
В соответствии с данным принципом:
ü При увеличении Т равновесие смещается в сторонуэндотермической реакции, а при уменьшении Т – в сторонуэкзотермической реакции.
ü Приувеличении общего давления (Po)равновесие смещается в сторону образованияменьшего числа молей газообразных реагентов (νi).
ü Приувеличении парциального давления (или концентраций) исходных веществравновесие смещается в сторону прямой реакции,при уменьшении концентрации (ci) исходных веществили приувеличении концентрации (ci) продуктов реакцииравновесие смещается в сторонуисходных реагентов.
Равновесный состав системы, если известен начальный состав, можно рассчитать, применяя закон действующих масс и составляя уравнения материального баланса.
Задача 22
Как увеличить выход продуктов реакции С(к) + СО2(г) = 2СО(г) ΔrН0298 =172,5 кДж >0
Решение
В соответствии с принципом Ле-Шателье вывести систему из состояния равновесия можно изменяя температуру, общее давление, парциальные давления газообразных реагентов или концентрации (активности) реагентов в растворах.
Чтобы повысить выход продукта СО нужно равновесие смещать вправо:
а) Увеличить Т системы, т.к. ∆rH0298 > 0 (При увеличении Т равновесие смещается в сторону эндотермической реакции);
б) Уменьшить Рсистемы, т.к прямая реакция идет с увеличением числа молей газообразных веществ (При снижении общего давления равновесие смещается в сторону образования большего числа молей газообразных реагентов).
в) Увеличить парциальное РСО2 и уменьшить парциальное РСО(выводить СО из сферы реакции)- при увеличении парциального давления (или концентраций) исходных веществ или при уменьшении концентрации (ci) продуктов реакции равновесие смещается в сторону прямой реакции.
Задача 23
Рассчитать энергию Гиббса реакции С(к)+СО2(г)=2СО(г) (ΔrН0298 =172,5 кДж, ∆r S0298 =.175,66 Дж/К) при Т = 1000 К и заданных начальных состояниях веществ:
а) при стандартных состояниях - ∆rG01000
б) при относительных парциальных давлениях СО2 и СО равных 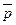 =10-4 – для СО2 и
=10-4 – для СО2 и 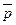 = 1 – для СО - ∆rG1000 (1)
= 1 – для СО - ∆rG1000 (1)
в) при относительных парциальных давлениях СО2 и СО равных 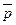 =1 – для СО2 и
=1 – для СО2 и 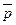 = 10-4 – для СО - ∆rG1000 (2)
= 10-4 – для СО - ∆rG1000 (2)
Сравните полученные результаты. Как смещается равновесие при изменении парциальных давлений газообразных компонентов реакции?
Решение
а) При стандартных состояниях веществ, т. е. относительных парциальных давлениях СО2 и СО равных 1, ΔrG0Т = ∆rH0298 - T∆rS0298 (считая ∆rС0р = 0, т.е. ∆rH0Т = ∆rH0298 и ∆rS0Т = ∆rS0298 - энтальпия и энтропия реакции не зависят от температуры)
Т=1000К ΔrG01000 =172,5 - 1000∙175,66 . 10 -3 = -3,16 кДж ˂ 0 – возможно самопроизвольное протекание реакции при стандартных состояниях и Т=1000К
б) Зависимость ΔrGT от давления выражается изотермой Вант Гоффа:
ΔrGТ = ∆rG0Т + RTln 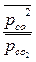
Т=1000 К ΔrG1000 = ∆rG01000 + RTln 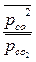
ΔrG1000 (1) = -3,16 + 8,31 . 10 -3 . 1000 ln(1/10-4) = 73,3 кДж ˃ 0 самопроизвольное протекание процесса при заданных начальных условиях и Т=1000 К невозможно.
в) при относительных парциальных давлениях СО2 и СО равных 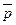 =1 – для СО2 и
=1 – для СО2 и 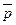 = 10-4 – для СО: ∆rG1000 (2) = ∆rG01000 + RTln
= 10-4 – для СО: ∆rG1000 (2) = ∆rG01000 + RTln 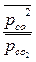
∆rG1000 (2) = -3,16 + 8,31 . 10 -3 . 1000 ln[(10-4).2/1] = -156,06 кДж ˂ 0 возможно самопроизвольное протекание процесса при заданных начальных условиях и Т = 1000 К.
∆rG1000 (2) ˂ ∆rG01000 ˂ 0 ˂ ΔrG1000 (1)
При уменьшении парциального давления продукта реакции – СО равновесие смещается вправо: ∆rG1000 (2) ˂ ∆rG01000 ˂ 0, а при уменьшении парциального давления исходного вещества СО2 равновесие смещается влево, в сторону исходных веществ: ∆rG1000 (1) ˃ 0 ˃ ∆rG01000 – при 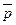 =10-4 для СО2 и
=10-4 для СО2 и 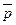 = 1 для СО возможна обратная реакция.
= 1 для СО возможна обратная реакция.
Адсорбция - поглощение одного вещества поверхностью другого вещества
Адсорбция – разновидность сорбции- поглощения одного вещества другим. Если вещество поглощает всем объемом, то происходит абсорбция
Адсорбция осуществляется вследствие наличия у поверхностных частиц избыточной поверхностной свободной энергии. Наличие неуравновешенной энергии у поверхностной частицы по сравнению с частицей в объеме приводит к накоплению тех или иных веществ на границе раздела фаз (тв-г, тв-ж, ж-г) т.е. происходит повышение концентрации вещества на границе раздела фаз - адсорбция
Адсорбент - вещество, которое поглощает, адсорбирует
Адсорбат – адсорбированное вещество, которое поглощается.
Десорбция - процесс, обратный адсорбции.
Количественная характеристика адсорбента – его удельная площадь поверхности S0:
S0 = S/ V, м2см-3 S0= S/ m, м2г-1
(Чем больше S0, тем лучше адсорбционная способность адсорбента (активированные угли, цеолиты, алюмосиликаты, силикагель (аморфный кремнезем – вещества с развитой поверхностью;S0 активированного 400 – 900 м2 г-1)
Количественная мера адсорбции адсорбата - величина адсорбции Г -избыток адсорбированного вещества в поверхностном слое и в объеме (разность концентрациий вещества в поверхностном слое и в общем объеме): [Г]=[моль/м2]; [моль/см2адсорбента]; [моль/г адсорбента]
Адсорбция: физическая и химическая.
Физическая адсорбция
-при взаимодействии адсорбата и адсорбента возникают вандерваальсовы взаимодействия (физическая природа сил); невысокий тепловой эффект (DН298 = –(8 – 20)кДж/моль); обратимый процесс - десорбция↑ с ростом Т (например, адсорбции газа активированным углем: СО2,г « СО2,адс ; Сl2,г « Cl2,адс ).
