Методика проведения опытов
Содержание
Введение.............................................................................................................. 4
1 Лабораторная работа №1
Калориметрические измерения: определение водяного числа калориметра
и удельной интегральной теплоты растворения соли.................................... 6
2 Лабораторная работа №2
Определение молярной массы неэлектролита криоскопическим методом... 12
3 Лабораторная работа №3
Определение кажущейся степени диссоциации хлорида калия
криоскопическим методом............................................................................... 19
4 Лабораторная работа №4
Изучение взаимной растворимости жидкостей в трехкомпонентной
системе с ограниченной растворимостью в жидком состоянии.................... 26
5 Лабораторная работа №5
Изучение адсорбции уксусной кислоты из водных растворов на угле........ 32
6 Лабораторная работа №6
Седиментационный анализ суспензии кварца в воде..................................... 42
7 Лабораторная работа №7
Получение гидрофобных золей и определение заряда коллоидных частиц 53
8 Лабораторная работа №8
Исследование коагулирующего действия ионов в зависимости от
величины их заряда......................................................................................... 60
Список рекомендуемой литературы.................................................................. 64
Заключение.......................................................................................................... 65
Использованная литература............................................................................... 66
Введение
Настоящие методические указания составлены в соответствии c рабочей программой по физической химии для направления подготовки бакалавров 270800 Строительство, профиль подготовки «Производство строительных материалов, изделий и конструкций». Они учитывают специфику данного направления подготовки бакалавров и различный первоначальный уровень химических знаний студентов, а потому являются актуальными.
Целью данной методической разработки является повышение эффективности преподавания физической химии. Это достигается существенной методической и дидактической поддержкой самостоятельной работы студентов при подготовке к защите тем лабораторных работ.
Настоящие методические указания наряду с методиками проведения опытов и обработки их результатов содержат методический материал, призванный помочь студенту в самоподготовке к защите тем лабораторных работ. Он включает теоретические пояснения к каждой работе, примеры решения типовых задач, перечень понятий и законов, которые должен знать студент, а также умений и навыков, которыми он должен обладать. В конце каждой лабораторной темы приводятся задания для самоконтроля.
В ходе лабораторных работ студенты должны приобрести навыки самостоятельной экспериментальной работы, выполнения химических расчетов, работы со справочной химической литературой, научиться сопоставлять, анализировать и интерпретировать данные опытов и на этой основе делать логичные и обоснованные выводы и заключения.
Для более эффективного использования времени аудиторных занятий предлагается заранее познакомиться с предстоящей работой, прочитав соответствующий раздел настоящих методических указаний, а при необходимости также конспекты лекций и определенные главы учебника. После выполнения опытов студенты защищают тему лабораторной работы. Для этого они должны:
˗ предъявить отчет о выполнении лабораторной работы, который оформляется в лабораторном журнале в соответствии с требованиями к форме и содержанию отчета;
˗ уметь изложить ход проведения лабораторных опытов, объяснить результаты эксперимента;
˗ по просьбе преподавателя составить соответствующие уравнения реакций, произвести расчеты, не выходящие за рамки типовых задач;
˗ показать удовлетворительные знания теоретических вопросов, не выходящих за рамки требований к уровню подготовки студентов (приводятся в методических указаниях для каждой лабораторной работы).
Отчет должен содержать название и цель работы, краткий конспект теоретической части (по желанию), название опыта, сжатое описание методики эксперимента, уравнения реакций, наблюдаемые эффекты, ответы на все вопросы, поставленные в заданиях.
Если на это есть указания, экспериментальные данные сводятся в таблицы. Расчеты определяемых величин приводятся полностью с необходимыми краткими пояснениями. При необходимости, полученные экспериментальные зависимости представляются в виде графиков. При построении графиков необходимо помнить следующее:
- размер графика должен быть не меньше, чем половина тетрадного листа;
- на осях координат через равные интервалы указываются единицы масштаба;
- точки должны наноситься на график в соответствии с выбранным масштабом без нанесения дополнительных линий их координат и отметок на осях;
- точки соединяются так, чтобы большинство из них попало на линию или было в одинаковой мере отдалено по обе стороны от нее.
Отчет обязательно должен содержать выводы либо по всей работе, либо по отдельным ее частям.
Лабораторная работа №1
Калориметрические измерения: определение водяного числа калориметра и удельной интегральной теплоты растворения соли
Цель: ознакомление с калориметрическим методом определения тепловых эффектов физико-химических процессов, определение водяного числа калориметра (суммарной теплоемкости калориметрической системы) и удельной интегральной теплоты растворения соли.
Оборудование и реактивы: калориметрическая система (рисунок 1.1), секундомер, мерный цилиндр, ртутный термометр, соли: KCl; Na2SO4 или другие по указанию преподавателя.
Теоретические пояснения
Калори́метр (от латинского calor — тепло) — прибор для измерения количества теплоты, выделяющейся или поглощающейся в каком-либо физическом, химическом или биологическом процессе.
Путем калориметрических измерений можно получить экспериментальные данные по теплоемкостям веществ и тепловым эффектам различных процессов. Величина и знак теплового эффекта ΔН определяется по изменению температуры калориметра.
Можно выделить два основных типа калориметров: приборы с постоянной и переменной температурой. В наших опытах используется второй тип. В ходе опыта температура системы изменяется, причем не только за счет протекания изучаемого процесса, но и частично за счет теплообмена с окружающей средой. Теплообмен в студенческих опытах стараются минимизировать, однако полностью устранить его не удается.
Теплообмен искажает истинные результаты опыта, поэтому он должен быть учтен. В настоящей работе это предлагается сделать графическим методом, который рассматривается в разделе, касающемся обработки результатов опыта.
В основе определения тепловых эффектов калориметрическим методом лежит уравнение (1.1).
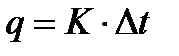 , (1.1)
, (1.1)
где 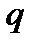 - общий тепловой эффект проводимого в калориметре процесса;
- общий тепловой эффект проводимого в калориметре процесса;
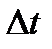 - изменение температуры в результате процесса;
- изменение температуры в результате процесса;
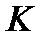 - суммарная теплоемкость калориметрической системы (водяное число).
- суммарная теплоемкость калориметрической системы (водяное число).
Следует помнить, что тепловой эффект q и энтальпия процесса ΔН имеют противоположные знаки:
- для экзотермического процесса q>0; ΔH<0;
- для эндотермического процесса q<0; ΔH>0
Водяное число К, называемое также постоянной калориметра, соответствует тому количеству теплоты, которое необходимо для изменения температуры системы на 1 градус.
Удельный тепловой эффект процесса, отнесенный к 1г вещества, измеряется в Дж/г и рассчитывается по формуле
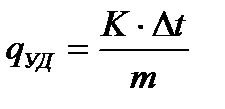 (1.2)
(1.2)
Водяное число можно рассчитать по формуле:
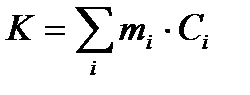 , (1.3)
, (1.3)
где mi – массы веществ, калориметра и вспомогательных устройств (мешалка, термометр, пробирка);
Сi – их удельные теплоемкости.
При обычных температурах для большинства твердых веществ истинные теплоемкости мало зависят от температуры, а удельные теплоемкости разбавленных водных растворов неорганических солей практически одинаковы (4,1 Дж/г·град).
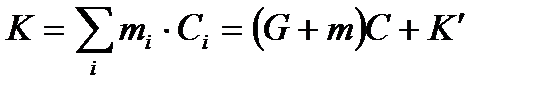 ,
,
где G – масса воды;
m – масса соли;
С – удельная теплоемкость раствора;
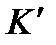 - теплоемкость калориметра и вспомогательных устройств.
- теплоемкость калориметра и вспомогательных устройств.
Если для серии опытов масса воды и массы солей остаются неизменными, то можно считать, что водяное число К будет величиной постоянной.
Для определения водяного числа в калориметре проводят такой процесс, тепловой эффект которого точно известен, например, растворение KCl в воде.
Зависимость удельной теплоты растворения KCl, выраженной в Дж/г, от температуры в интервале от 100С до 300С имеет следующий вид:
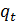 =-(334,3–3,866·t), (1.4)
=-(334,3–3,866·t), (1.4)
где t – средняя температура опыта, 0С.
t=0,5(t1+t2), (1.5)
где t1 и t2 – температуры начала и окончания растворения.
Водяное число калориметра рассчитывают по формуле:
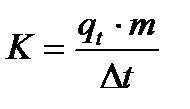 (1.6)
(1.6)
Зная величину водяного числа калориметра, можно определить удельную интегральную теплоту растворения любой неорганической соли по формуле (1.2).
Методика проведения опытов
