Абсорбційні оптичні методи аналізу
Ці методи базуються на використанні об’єднаного закону світлопоглинання Бугера-Ламберта-Бера:
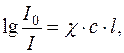
де I0 – інтенсивність світла, що падає на розчин речовини;
I – інтенсивність світла, що пройшло через розчин речовини;
χ – показник поглинання розчину;
c – концентрація досліджуваного розчину;
l – товщина шару розчину;
Величина 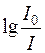 називається оптичною густиною і позначається літерою D.
називається оптичною густиною і позначається літерою D.
Показник поглинання χ – константа для кожної речовини при певній довжині хвилі світла. Вона дорівнює оптичній густині розчину з товщиною шару в 1см і концентрацією в 1моль/дм3. Якщо концентрацію виражають в моль/дм3, тоді χ позначають через ε і називають молярним коефіцієнтом екстинкції. Отже:
D = ε·c·l.
Молярний коефіцієнт поглинання ε характеризує внутрішні властивості речовини і не залежать від об’єму розчину, товщини шару та інтенсивності освітлення. Тому величина ε – найбільш важлива та об’єктивна характеристика можливої чутливості фотометричного визначення. Значення ε в області максимуму для різних поглинаючих світло речовин дуже відрізняється. Так, смуги поглинання йонів Cu2+, Ni2+ та інших у видимій частині спектра мають низькі значення ε порядка 10-100. Забарвлені амоніакати, пероксидні та інші одноріднолігандні комплекси мають значення ε≈102-103. Багато комплексів з органічними реактивами (наприклад, алізаринати, дітізонати та ін.) мають дуже високі значення ε – порядка 104-105.
Оптична густина розчину, що містить декілька забарвлених речовин, має властивість адитивності. У присутності в розчині декількох забарвлених речовин, кожна з них буде давати свій адитивний внесок в оптичну густину D:
D = D1+D2+…+Dn.
Світло поглинається розчином вибірково: при деяких довжинах хвиль поглинання світла відбувається інтенсивно, а при інших світло не поглинається. Інтенсивно поглинаються кванти світла, енергія яких hν дорівнює енергії збудження частинки і вірогідність її поглинання більша за нуль. Молярний коефіцієнт поглинання при цих довжинах хвиль має високе значення.
Розподілення за частотами або зо довжинами хвиль значень молярного коефіцієнта поглинання називається спектром поглинання.
Переважно спектр поглинання виражають у вигляді графічної залежності оптичної густини D або молярного коефіцієнта поглинання ε від частоти ν або довжини хвилі λ падаючого світла. Замість D або ε часто відкладають на графіку їх логарифми.
Повне підпорядкування закону Бугера-Ламберта-Бера виконується тільки при монохроматичному випромінюванні, яке має місце у спектрофотометрії. При використанні немонохроматичного випромінювання, що має місце у фотоколориметрії, цей закон має наближене значення, що пов’язане із постійністю величини коефіцієнта світлопоглинання у певному інтервалі довжини хвиль, які отримують за допомогою світлофільтрів. Вони дозволяють виділити порівняно вузький інтервал довжин хвиль в області зони поглинання досліджуваної речовини. При цьому найменші помилки будуть відчутні для речовини з широкою смугою поглинання.
Крім того, закон Бугера-Ламберта-Бера справедливий лише у тому випадку, коли із зміною концентрації речовини вона не зазнає хімічних змін: не відбувається асоціація молекул при високій концентрації речовини, а також речовина не дисоціює на йони. Цей закон без обмежень можна застосовувати тільки для розведених розчинів, для концентрацій речовин менше 0,01моль/дм3. При більших концентраціях частинки, що поглинають світло, настільки близько розташовані одна біля одної, що кожна частинка впливає на розподілення заряду сусідніх частинок, що призводить до зміни здатності частинок поглинати світло даної довжини хвилі. У цьому випадку спостерігається відхилення від прямолінійної залежності інтенсивності поглинання світла від концентрації речовини в розчині.
Похибки вимірювання можуть виникати також через те, що при проходженні через межу повітря – скло близько 4 % світлового потоку відбивається. Цю похибку можна звести до мінімуму, якщо порівнювати світлові потоки, які проходять крізь кювети з досліджуваним та стандартним (або холостим) розчинами.
Хімічні причини відхилень від закону Бугера-Ламберта-Бера пов’язані з дисоціацією та асоціацією хімічних сполук, впливом інших речовин, присутніх у розчині, а також з іншими хімічними процесами, що відбуваються у розчинах з утворенням гідроксокомплексів, взаємодією з розчинником з утворенням кислих солей, зміною складу комплексних сполук у зв’язку із ступінчастим характером їх утворення та ін.
