Понятие об аллотропии. Аллотропные видоизменения кислорода, водорода, углерода
Аллотропия связана либо с разным числом атомов в молекуле, либо со строением.
Аллотропные видоизменения есть у большинства химических элементов. Например, сера бывает ромбическая, моноклинная, пластическая; углерод существует в виде графита, алмаза, карбина, фуллере-на. Известно серое и белое олово; фосфор красный, белый и черный.
Кислород может существовать в виде двух аллотропных видоизменений: кислород О2 и озон О3.
При сравнении физических свойств кислорода и озона целесообразно вспомнить, что это газообразные вещества, различающиеся по плотности (озон в 1,5 раза тяжелее кислорода), температурам плавления и кипения. Озон лучше растворяется в воде.
Кислород в нормальных условиях — газ, без цвета и запаха, озон — газ голубого цвета с характерным резким, но приятным запахом.
Есть отличия и в химических свойствах.
Озон химически активнее кислорода. Активность озона объясняется тем, что при его разложении образуется молекула кислорода и атомарный кислород, который активно реагирует с другими веществами. Например, озон легко реагирует с серебром, тогда как кислород не соединяется с ним даже при нагревании:
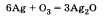
Но в то же время и озон и кислород реагируют с активными металлами, например с калием К.
Получение озона происходит по следующему уравнению:
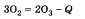
Реакция идет с поглощением энергии при прохождении электрического разряда через кислород, например во время грозы, при сверкании молнии. Обратная реакция происходит при обычных условиях, так как озон — неустойчивое вещество. В природе озон разрушается под действием газов, выбрасываемых в атмосферу, например фреонов, в процессе техногенной деятельности человека.
Результатом является образование так называемых озоновых дыр, т. е. разрывов в тончайшем слое, состоящем из молекул озона.
Элементарный углерод образует три аллотропных видоизменения: алмаз, графит и карбин.
Алмаз – бесцветное, прозрачное кристаллическое вещество, чрезвычайно сильно преломляющее лучи света. Атомы углерода в алмазе находятся в состоянии sp3-гибридизации. В возбужденном состоянии происходит распаривание валентных электронов в атомах углерода и образование четырех не спаренных электронов.
 Каждый атом углерода в алмазе окружен четырьмя другими, расположенными от него в направлении от центра в тетраэдров к вершинам. Расстояние между атомами в тетраэдрах равно 0, 154 нм. Прочность всех связей одинакова. Таким образом, атомы в алмазе «упакованы» очень плотно. При 20оС плотность алмаза составляет 3,1515 г/см3 . Этим объясняется его исключительная твердость. Алмаз плохо проводит электрический ток. Основная масса , образования алмазов – небольшие кристаллы и алмазная пыль.
Каждый атом углерода в алмазе окружен четырьмя другими, расположенными от него в направлении от центра в тетраэдров к вершинам. Расстояние между атомами в тетраэдрах равно 0, 154 нм. Прочность всех связей одинакова. Таким образом, атомы в алмазе «упакованы» очень плотно. При 20оС плотность алмаза составляет 3,1515 г/см3 . Этим объясняется его исключительная твердость. Алмаз плохо проводит электрический ток. Основная масса , образования алмазов – небольшие кристаллы и алмазная пыль.
Алмазы при нагревании без доступа воздуха выше 1000оС превращается в графит. При 1750оС превращение алмаза в графит происходит быстро.
Графит – серо-черное кристаллическое вещество с металлическим блеском, жирное на ощупь, по твердости уступает даже бумаге.
Атомы углерода в кристаллах графита находятся в состоянии sp2 – гибридизации: каждый из них образует трех ковалентные ơ-связис соседними атомами. Углы между направлениями связей равна 120о. В результате образуется сетка, состоящая из правильных шестиугольников. Расстояние между соседними ядрами атомов углерода внутри слоя составляет 0,142нм.
Графит имеет низкую механическую прочность и легко расщепляется на чешуйки, которые сами по себе очень прочны. Связь между слоями атомов углерода в графите частично имеет металлический характер. Этим объясняется тот факт, что графит хорошо проводит электрический ток, но все же не так, как металл.
При нагревании без доступа воздуха графит не претерпевает никакого изменения до 3700оС. При указанной температуре он выгоняется, не плавясь. Графит термодинамичен, устойчив в широком интервале температур и давлений. Плотность составляет 2,256 г/см3.
