Разделение и концентрирование
Концентрирование применяют, если намеченные способы измерения аналитического сигнала недостаточно чувствительны и не позволяют определить компонент в исследуемом веществе на соответствующем концентрационном уровне. Например, необходимо точно определять содержание канцерогенного углеводорода 3,4-бензпирена (БП) в природной воде, где его предполагаемое содержание находится на уровне 10-9 - 10-8 г/л. Определять концентрацию БП можно фотометрическим методом, но при столь низком содержании оптическая плотность раствора будет близка к нулю. Чтобы измерение оптической плотности было достаточно точным, концентрация БП должна быть выше 10-6 г/л, а еще лучше – выше 10-5 г/л. Очевидно, для фотометрического определения БП в воде надо заранее сконцентрировать его, а именно - повысить концентрацию на 3-4 порядка.
Разделение применяют, если имеющиеся в распоряжении аналитика способы измерения аналитического сигнала недостаточно селективны, то есть сигнал определяемого компонента будет искажен другими компонентами той же пробы. Так, при фотометрическом определении 3,4-бензпирена оптическая плотность раствора пробы на выбранной длине волны создается не только этим веществом, но и другими ароматическими углеводородами, присутствующими в анализируемой воде. Чтобы получить правильный результат анализа, надо перед измерением отделить БП от других ароматических углеводородов.
Количественные характеристики процессов разделения и концентрирования
При установившемся межфазном равновесии химические потенциалы вещества Х, распределяемого между двумя фазами, равны, а отношение активностей Х в этих фазах - постоянная величина, которую называют константой распределения:
КD = 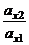
Коэффициент разделения (χ) двух компонентов пробы (Х и X*) позволяет заранее оценить возможность их разделения по данной методике. Величина χ равна отношению коэффициентов распределения: χ = Dх / Dх* . Чем сильнее отличается χ от единицы, тем лучше будет идти процесс разделения Х и X* . Однако при этом должно выполняться и дополнительное условие: произведение Dх.Dх* должно быть по возможности ближе к единице. Так, если Dх = 103, а Dх* = 10-3 , коэффициент разделения χ =106. Тогда Х извлекается, а Х* практически не извлекается. Если же Dх = 109, а Dх* = 103, коэффициент разделения имеет ту же величину, что и в предыдущем случае, но извлекаются оба компонента, разделения нет.
Коэффициент концентрирования (N) равен отношению концентрации Х в новой фазе (в концентрате) к исходной концентрации Х в пробе. Если потерь Х в ходе его извлечения не было, то коэффициент концентрирования приблизительно равен отношению объема пробы (V1) к объему концентрата (V2), или отношению соответствующих масс:
N = 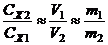
11 вопрос
Соосождение.
Соосаждение — это распределение микрокомпонента между раствором (жидкая фаза) и осадком (твердая фаза), причем микрокомпонент не образует в данных условиях собственной твердой фазы (теоретические аспекты соосаждения см гл 9). При соосаждении имеют место адсорбция, ионный обмен, окклюзия, изоморфное соосаждение, образование химических соединений и другие виды взаимодействия микрокомпонентов с компонентами осадка. На соосаждение микрокомпонентов оказывают влияние состояние микрокомпонента в растворе, крис-таллохимические свойства осадка (структура, поверхность и др), процесс старения осадка, кислотность раствора, порядок добавления реагентов, температура, время и другие факторы. Микрокомпонент соосаждается на коллекторе
Коллекторы (носители) — это малорастворимые неорганические или органические соединения, которые должны полностью захватывать нужные и не захватывать мешающие микрокомпоненты и компоненты матрицы. В качестве неорганических коллекторов используют гидро-ксиды, сульфиды, фосфаты и др., т.е. преимущественно соединения, образующие аморфные осадки с большой активной поверхностью
Среди органических коллекторов различают в основном три вида: малорастворимые ассоциаты, состоящие из объемистого органического катиона и аниона (например, катион кристаллического фиолетового Или метиленового синего и тиоцианат или иодид); хелаты (дитио-карбаминаты, дитизонаты, /?-дикетонаты и т.п.) и индифферентные органические соединения, которые не содержат комплексообразующих группировок.
Следует отметить, что механизм соосаждения для этих двух типов коллекторов будет неодинаковым. В случае неорганического коллектора распределение обусловлено прежде всего его ионной природой и неравномерным распределением зарядов по поверхности из-за наличия поверхностных дефектов-246
Органические же коллекторы образуют молекулярную решетку, на которой сорбция ионов практически не происходит. Эти различия между коллекторами объясняют их высокую избирательность. Например, гидрохлоридом индулина из хлоридных растворов, содержащих галлий и алюминий в соотношении 1:8-109, можно выделить ~90% галлия; при этом алюминий практически не захватывается. Эффективность органических коллекторов настолько высока, что селективное выделение микрокомпонента осуществляется, когда его отношение к макрокомпоненту составляет 1:1015. Преимущество органических коллекторов состоит также в простоте обработки: из концентрата можно легко выжечь органическое вещество; концентрат удобно растворить в органическом растворителе.
Используют следующие приемы соосаждения: введение макрокомпонента и подходящего для него реагента-осадителя (как неорганического, так и органического); частичное осаждение матрицы (макроком-донент присутствует в пробе); введение органического соединения в органическом растворителе, смешивающемся с водой (после разбавления водой соосадитель выпадает в осадок, увлекая за собой комплексы микроэлементов)
12 вопрос
Адсорбция.
Адсорбцией называют явление накопления одного вещества на поверхности другого. Накопление же его внутри другого вещества называют абсорбцией. Вещество, которое адсорбируется, называется адсорбтивом; вещество, на поверхности которого происходит адсорбция,— адсорбентом.
Адсорбция представляет собой обратимый процесс. Процесс, обратный адсорбции, называется десорбцией. Удаление адсорбированных веществ с адсорбентов при помощи растворителей называют элюцией.
Различают молекулярную и ионную адсорбцию в зависимости от того, что адсорбируется — молекулы или ионы вещества. При адсорбции может происходить химическое взаимодействие адсорбента и адсорбтива,
Такая адсорбция называется хемосорбцией.
Адсорбция зависит от химической и физической природы адсорбента и адсорбтива. Так, например, на активированном угле обычно лучше адсорбируются ароматические вещества, чем алифатические. Адсорбция веществ, относящихся к одному и тому же гомологическому ряду, часто возрастает с увеличением длины углеродной цепи. Нередко адсорбция повышается с увеличением числа двойных связей в адсорбтиве.
Разновидностью обменной адсорбции является ионообменная адсорбция. Ее сущность заключается в том, что некоторые адсорбенты имеют химические группы, которые диссоциируют и замещают свои ионы на одноименно заряженные ионы, содержащиеся в растворе. Если из раствора обмениваются ионы Н+ или ОН-, то в результате обмена в растворе меняется соотношение этих ионов и изменяется рН. Так, коллоидные частицы Fе(ОН)3 могут обменивать адсорбированные ионы С1- на ОН-, что ведет к преобладанию в растворе ионов Н+ и, следовательно, рН раствора смещается в кислую сторону. Такой частный случай ионообменной адсорбции называется гидролитической.
13 вопрос
Экстракция.
Экстракция — это метод разделения и концентрирования вещств, основанный на распределении вещества между двумя несмешивающи-мися фазами, чаще всего между двумя жидкостями (обычно между водой и органическим растворителем). Известны примеры, когда второй фазой может быть расплав какого-либо органического вещества (нафталин, дифенил, бензофенон), содержащий органический реагент, например 8-оксихинолин. После распределения вещества фазы охлаждают, расплав застывает и его отделяют от водной фазы.
При экстракции одновременно протекают процессы- образование экстрагируемых соединений; распределение экстрагируемых соединений между водной и органической фазами; реакции в органической фазе (диссоциация, ассоциация, полимеризация). Соединение (обычно в органической фазе), ответственное за образование экстрагируемого соединения, называют экстрагентом. Инертные органические растворители, такие, как хлороформ, тетрахлорид углерода, бензол, применяемые для улучшения физических и экстракционных свойств экст-рагента, называют разбавителями. Органическую фазу, отделенную от водной фазы и содержащую экстрагированные соединения, называют экстрактом. Перевод вещества из органической фазы в водную называют реэкстракциеи, а раствор, используемый для реэкстракции, — Реэкстрагентом

14 вопрос
Хроматография.
Хроматография — наиболее часто используемый аналитический метод. Новейшими хроматографическими методами можно проанализировать газообразные, жидкие и твердые вещества с молекулярной массой от 1 до 106. Такие достоинства, как универсальность, экспрессность и чувствительность, делают хроматографию важнейшим аналитическим методом.
Хроматография — это физико-химический метод разделения веществ, основанный на распределении компонентов между двумя фазами — неподвижной и подвижной. Неподвижной (стационарной) фазой служит твердое вещество (его часто называют сорбентом) или пленка жидкости, нанесенная на твердое вещество. Подвижная фаза представляет собой жидкость или газ, протекающий через неподвижную фазу.
КЛАССИФИКАЦИЯ ХРОМАТОГРАФИЧЕСКИХ МЕТОДОВ
В основу общепринятых классификаций многочисленных хромато-графических методов положены следующие признаки: агрегатное состояние подвижной и неподвижной фаз, механизм взаимодействия сорбент—сорбат, форма слоя сорбента (техника выполнения), цель хроматографирования.
По агрегатному состоянию фаз хроматографию разделяют на газовую и жидкостную. Газовая хроматография включает газожидкостную и газотвердофазную, жидкостная — жидкостяо-жидкостную, жидкостнснгвердофазную и жидкостно-гелевую. Первое слово в названии метода характеризует агрегатное состояние подвижной фазы, второе — неподвижной.
По механизму взаимодействия сорбента и сорба-та можно выделить несколько видов хроматографии: распределительная хроматография основана на различии в растворимости разделяемых веществ в неподвижной фазе (газовая хроматография) или на различии в растворимости веществ в подвижной и неподвижной жидких фазах; ионообменная хроматография — на разной способности веществ к ионному обмену; адсорбционная хроматография — на различии в адсорбируемости веществ твердым сорбентом; эксклюзионная хроматография — на различии в размерах и формах молекул разделяемых веществ, аффинная хроматография — на специфических взаимодействиях, характерных для некоторых биологических и биохимических процессов. Существуют пары веществ, реагирующих в растворах с высокой избирательностью, например антитело и антиген, фермент и его субстрат или ингибитор, гормон и соответствующий рецептор, и т.п. Если одно из соединений пары удерживается ковалентной связью на носителе, то последний можно использовать для избирательного извлечения второго соединения пары.
Этими видами не исчерпываются все механизмы разделения, например существует осадочная хроматография, основанная на образова нии отличающихся на растворимости осадков разделяемых веществ г сорбентом, адсорбционно-комплексообраэователъная, основанная на образовании координационных соединений разной устойчивости в фазе или на поверхности сорбента, и др. Следует помнить, что классификация по механизму весьма условна: ее используют в том случае, если известен доминирующий механизм; часто процесс разделения протекает сразу по нескольким механизмам.
По технике выполнения выделяют колоночную хроматографию, когда разделение проводится в специальных колонках, и плоскостную хроматографию, когда разделение проводится на специальной бумаге (бумажная хроматография) или в тонком слое сорбента (тонкослойная хроматография).
По цели хроматографирования выделяют аналитическую хроматографию (качественный и количественный анализ); препаративную хроматографию (для получения веществ в чистом виде, для концентрирования и выделения микропримесей); промышленную (производственную) хроматографию для автоматического управления процессом (при этом целевой продукт из колонки поступает в датчик). Хроматографию широко используют для исследования растворов, каталитических процессов, кинетики химических процессов и т.п
15 вопрос
