Опыт 1. Получение коллоидного раствора крахмала
В пробирку вносят 5-6 капель 1% раствора глюкозы, С6Н12О6 добавляют 2-3 капли 10% раствора едкого натра NaOH и по каплям 5% раствора сульфата меди CuSO4 до образования легкой неисчезающей мути. Пробирку осторожно нагревают. Сначала появляется желтое окрашивание жидкости, а затем образуется желтый или кирпично-красный осадок. Окислителем является гидрат окиси меди, который при восстановлении постепенно переходит в гидрат закиси меди, а затем в закись меди.
CuSO4 + 2 NaOH → Cu(OH)2 + Na2SO4
глюкоза + Cu(OH)2 → продукты окисления глюкозы + 2CuOH + Н2О
Опыт 2. Открытие в моносахаридах гидроксильных групп
В две пробирки помещают раздельно по 5-6 капель 1% растворов глюкозы и фруктозы. В обе пробирки добавляют по 2-3 капли 10% раствора едкого натра и перемешивают. Затем в каждую пробирку приливают 1 каплю 1% раствора сернокислой меди. Образуются алкоголяты меди глюкозы и фруктозы, вследствие чего появляется синее окрашивание.
Опыт 3. Кислотный гидролиз сахарозы
В пробирку вносят 10-12 капель 1% раствора сахарозы и прибавляют 2-3 капли 10 % раствора серной кислоты. Смесь кипятят 2-3 минуты. После этого содержимое нейтрализуют по лакмусу. Записать объяснить полученные результаты.
Опыт 4. Открытие гидроксильных групп в дисахаридах
В пробирку помещают по 5-6 капель 1% раствора сахароза. Затем добавляют 2-3 капли 10 % раствора едкого натра, перемешивают и приливают по 1 капле 5% раствора сульфата меди появляется синее окрашивание в результате образования алкоголятов сахарозы.
Контрольные вопросы
1. Коллоидные растворы
2. Получение коллоидного раствора крахмала на лабораторных занятиях
Рекомендуемая литература
1. Стрепихеев А.А., Дереицкая В.А Основы высокомолекулярных соединений. - М: Химия, 1976г.
2. Торопцева Л.М., Белогородская К.В., Бондаренко В.М Лабораторный практикум по химии технологии высокомолекуляных соединений. - Л: Химия, 1972г.
Контрольные задания для СРС
1. Общее свойства крахмала
2. Макромолекулы крахмала
3. Получение крахмала в производстве
4. Химическое превращение целлюлозы
Лабораторная работа № 3
Получение резольных феноло –формальдегидных смолi XBwfxxlPyvHJ2QgV99SyeGoxq+YSsGcKXFCWJzH6B92L0kHziNtlFl9FEzMc3y4pD65XLkO7SnA/ cTGbJTeca8vCjbm3PIJHVmP7PmwfmbNdmwecj1vox/tZq7e+MdLAbBVAqjQHB147vnEnpMbp9ldc Ok/15HXYstPfAAAA//8DAFBLAwQUAAYACAAAACEACkPW498AAAALAQAADwAAAGRycy9kb3ducmV2 LnhtbEyPzW7CMBCE75X6DtZW6q04QBpQGgdVSFw4IBFaqUcTL4nV+Ee2A+nbdzm1x535NDtTbSYz sCuGqJ0VMJ9lwNC2TmnbCfg47V7WwGKSVsnBWRTwgxE29eNDJUvlbvaI1yZ1jEJsLKWAPiVfch7b Ho2MM+fRkndxwchEZ+i4CvJG4WbgiywruJHa0odeetz22H43oxFw0c3Xlhd+dwj73O2Pemw+/UGI 56fp/Q1Ywin9wXCvT9Whpk5nN1oV2SBgtcxeCSVjni+AEbEq7sqZlOU6B15X/P+G+hcAAP//AwBQ SwECLQAUAAYACAAAACEAtoM4kv4AAADhAQAAEwAAAAAAAAAAAAAAAAAAAAAAW0NvbnRlbnRfVHlw ZXNdLnhtbFBLAQItABQABgAIAAAAIQA4/SH/1gAAAJQBAAALAAAAAAAAAAAAAAAAAC8BAABfcmVs cy8ucmVsc1BLAQItABQABgAIAAAAIQBmMm3/nAIAAK0FAAAOAAAAAAAAAAAAAAAAAC4CAABkcnMv ZTJvRG9jLnhtbFBLAQItABQABgAIAAAAIQAKQ9bj3wAAAAsBAAAPAAAAAAAAAAAAAAAAAPYEAABk cnMvZG93bnJldi54bWxQSwUGAAAAAAQABADzAAAAAgYAAAAA " fillcolor="white [3212]" strokecolor="white [3212]" strokeweight="2pt"/>
Цель:Получение новолака
Приборы и реактивы:трехгорлая колба, обратный холодильник, термометр, чашка фарфоровая, водяная баня, лист жести, фенол — 9,4 г; формалин - 4 мл (4 г); НС1 - 0,1 мл.
Реакция протекает по схеме:
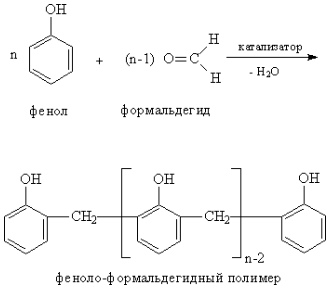

Теоретические основы
В процессах поликонденсации происходит объединение многих молекул в одну макромолекулу в результате химического взаимодействия между функциональными группами, которое сопровождается образованием низкомолекулярных веществ (воды, хлористого водорода, аммиака и т.д.). Пластические массы на основе фенолоформальдегидных смол обладают высокой прочностью, химической стойкостью, хорошими электроизоляционными свойствами.
Хорошо изученной реакцией этого типа является взаимодействие фенолов с альдегидами в кислой или щелочной среде. Большое влияние на свойства образующихся полимеров оказывает соотношение исходных веществ. Например, если количество формальдегида не превышает эквимолекулярного по отношению к фенолу, то образуются линейные термопластичные смолообразные олигомеры, называемые новолаками. Если фенол взят хотя бы в небольшом избытке, образуются продукты поликонденсации, называемые резолами. Резолы также плавятся и растворяются в органических растворителях, но в отличие от новолаков при нагревании переходят в неплавкое и нерастворимое состояние за счет образования пространственной структуры. Вначале образуется резитол, который не плавится и не растворяется, но может набухать в растворителях и слегка размягчается при нагревании, так как имеет небольшое число поперечных связей между молекулами. На стадии отверждения происходит образование неплавкого, нерастворимого и ненабухающего продукта поликонденсации, называемого резитом. В зависимости от поведения при повышенных температурах полимеры разделяются на термопластичные и термореактивные. Термопластичные полимеры способны к пластическому течению при повышенных температурах, а при охлаждении они затвердевают, сохраняя заданную форму. Такой цикл превращений может повторяться неоднократно. Термореактивные полимеры имеют стадию пластического течения при повышенной температуре, но при этом происходит отверждение и они переходят в неплавкое состояние. Они не способны к повторному формованию.
Другим примером реакций поликонденсации является получение амидо-формальдегидных полимеров на основе карбамида и формальдегида. При этом в зависимости от условий поликонденсации могут образовываться полиметиленкарбамиды линейного, циклолинейного и пространственного строения.
Карбамидо-формальдегидные олигомеры и полимеры широко используются в качестве клеев. Отвердитель (катализатор) может способствовать снижению температуры отверждения клея, в результате чего получается клей холодного отверждения. Холодному отверждению способствуют добавки хлорида аммония, трихлоруксусной кислоты, нефтяных сульфокислот. В водных растворах соль реагирует со свободным формальдегидом, освобождая соответствующую сильную кислоту. Это приводит к снижению рН клея и ускоряет отверждение. Наиболее достоверной реакцией отверждения является следующая реакция:
4 NН4Сl + 6 СН2O → (СН2)6N4 + 6Н2O + 4 НСl
Отвердитель вводят в таком количестве, чтобы получить клей с достаточной жизнеспособностью, т.е. временем, в течение которого клей сохраняет свои клеящие свойства. Жизнеспособность клея уменьшается с увеличением количества отвердителя.
Порядок выполнения работы
1. В круглодонную колбу вместимостью 100 мл помещают 1 г фенола и добавляют 1 мл формалина (40 %-ый раствор формальдегида в воде).
2. Приливают 0,1мл концентрированной HCl, присоединяют обратный холодильник и нагревают на водяной бане при 90-1000С в течение 20-40мин. Нагревание прекращают после расслоения смеси.
3. Воду сливают, а остаток выливают в фарфоровую чашку, на железный лист или на лист картона.
4. Промывают теплой водой до нейтральной реакции по метиловому оранжевому и высушивают. Образуется твердый продукт – термопластичный полимер (новолак), растворимый в ацетоне.
5. Чтобы превратить новолачный полимер в резольный, к нему подливают 0,5 мл насыщенного раствора уротропина и осторожно нагревают, не доводя до осмоления. Через несколько минут в пробирке получается продукт серно – желтого цвета – термореактивный полимер. Это соединение можно также получить, взяв в избытке формалин.
Контрольные вопросы.
1. Агрегатное состояние высокомолекулярных соединений
2. Агрегатное состояние низкомолекулярных соединений
3. Применение новолака
Рекомендуемая литература
1. Стрепихеев А.А., Дереицкая В.А Основы высокомолекулярных соединений. - М: Химия, 1976г.
2. Торопцева Л.М., Белогородская К.В., Бондаренко В.М Лабораторный практикум по химии технологии высокомолекуляных соединений. - Л: Химия, 1972г.
