Алкилирование по атому азота(N-алкилирование)
В качестве алкилирующих агентовиспользуют алкил- и арилгалогениды, непредельные соединения, спирты, эфиры, эпоксисоединения, диалкилсульфаты, эфиры аренсульфокислот. Поэтому чаще всего N-алкилирование (арилирование) можно рассматривать как реакции нуклеофильного замещения (SN2, SNAr и др.) или нуклеофильного присоединения (AN). Особенности рассматриваемого процесса в большой степени зависят от используемого реагента.
Алкилирование аминов галогенидамиидет по схеме:

Процесс сопровождается выделением галогеноводорода, который образует аммониевые соли и затрудняет реакцию, поэтому в реакционную массу добавляют вещества, связывающие кислоту. Ими могут быть сам амин, карбонаты натрия, калия, кальция или щелочь. Например, при получении N-бензиланилина (производство диазолина) для этих целей используют гидрокарбонат натрия:
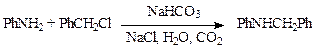
Повышение нуклеофильности субстрата (амина, амида) существенно влияет на его активность и скорость реакции алкилирования. В данном случае нуклеофильность, а, следовательно, и активность субстрата, также, как и его pKa, увеличивается от сульфамида до третичного амина:
–SO2NH2 < –CONH2 < ArNH2 < C5H5N < NH3 < RNH2 < R2NH < R3N
Алифатические амины и аммиак алкилируются легко, но процесс сопровождается полиалкилированием, что объясняется образованием более активного нуклеофила, чем исходный амин (см. главу 5 «Замена атома галогена на аминогруппы»):
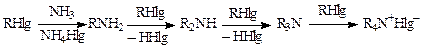
Тем не менее, реакцию широко используют в химико-фармацевтической промышленности, т.к. многие лекарственные препараты выпускаются в виде четвертичных аммонийных солей, например, парамион и др.:
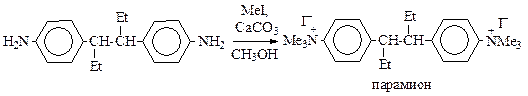
Алкилирование ароматических аминов идет труднее, чем алкиламинов, но селективнее. Это объясняется тем, что нуклеофильность их в большей степени зависит от заместителей в ядре, чем от заместителей, находящихся у атома азота. Так, п-толуидин более нуклеофилен, чем вторичный амин N-метиланилин:
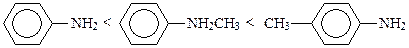
Активность вторичного жирноароматического амина выше, чем ариламина, но не настолько, как в алифатическом ряду. Поэтому используя низкие температуры, избыток субстрата и другие приемы, можно получать смешанные аминосоединения с высоким выходом:
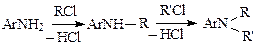
Амиды карбоновых и сульфоновых кислот, нуклеофильность которых очень низкая, алкилируются намного труднее, чем амины, но зато селективно, что позволяет синтезировать чистые первичные и вторичные амины (см. главу 5, «Замена атома галогена на аминогруппы»).
Алкилирующий агент также влияет на скорость реакции. Быстрее всего реагируют аллильные, бензильные, метильные и первичные галогениды (см. механизм SN2).
Как правило, алкилгалогенид является более простой молекулой, но в ряде случаев он является структурной основой лекарственного вещества, например, в производстве тримекаина:
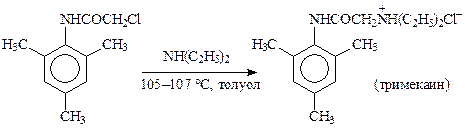
При использовании полигалогенида можно избирательно заместить более хорошо уходящий или более активный галоген:
В производстве нейролептика метеразина осуществляется замещение более хорошо уходящей группы (бромид иона) при алкилировании метилпиперазина 3-хлор-1-бромпропаном (в среде толуола в присутствии мелкоизмельченного NaOH с азеотропной отгонкой воды и возвратом толуола):
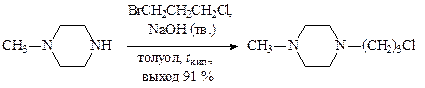
Ниже приведены примеры замещения более активного галогена в синтезах антиаритмического препарата орнида:
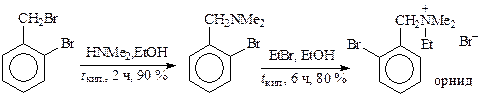
Условия реакции зависят от строения и свойств как субстрата, так и галогенида. Так, при взаимодействии алкилгалогенидов с аминами температура реакции обычно до 100 °С. Активированные арилгалогениды в процессах арилирования реагируют с аминами примерно при 150 °С. В большинстве случаев реакцию можно вести при атмосферном давлении в аппарате с обратным холодильником.
Однако при работе с низкокипящими веществами, такими, как метил- и этилхлориды (CH3Cl, C2H5Cl), которые значительно дешевле соответствующих бромидов и иодидов, алкилирование ведут в автоклавах, что является основным недостатком этого метода. Реагенты обычно берут в стехиометрическом соотношении. Так, алкилирование анилина этилхлоридом до диэтиланилина ведут в присутствии мела (или извести) при 125 °С под давлением 1,0—1,2 МПа 12 часов.
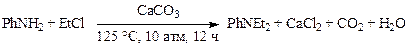
N-Алкилирование галогеноспиртами и эпоксисоединениями применяется в синтезе противоопухолевых препаратов. Для введения этанольного остатка в аминогруппу используют водный раствор этиленхлоргидрина (синтезы циклофосфана и проспидина):

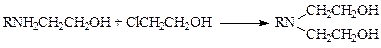
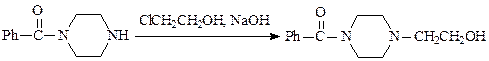
Однако наряду с N-алкилированием идет и О-алкилирование.
Поэтому вместо этиленхлоргидрина часто используют окись этилена.Для получения монозамещенного производного реакцию ведут в большом избытке амина в присутствии воды. Для введения двух гидроксиэтильных остатков берут избыток окиси этилена и процесс проводят при небольшом давлении. Температура алкилирования обычно ниже 100 °С. Так, в синтезе хлорбутина реакцию гидроксиэтилирования проводят при температуре около 5 °С, сарколизина — не выше 25 °С:
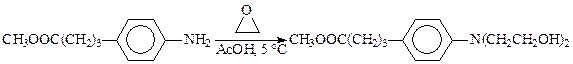
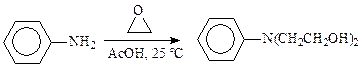
Смесь окиси этилена с воздухом взрывается, поэтому алкилирование ведут при полном отсутствии воздуха, что достигается продувкой аппарата азотом.
Диметилсульфатприменяется для N-алкилирования в производстве целого ряда лекарственных препаратов. Ниже приводятся примеры использования его в синтезе азафена.
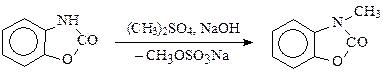
Механизм реакции SN2. В мягких условиях (водный раствор, низкая температура) используется лишь одна метильная группа диметилсульфата. Для полного использования диметилсульфата необходимо проводить алкилирование при температуре около 100 °С в щелочной среде.
К достоинствам диметилсульфата можно отнести высокую реакционную способность, относительную дешевизну и возможность проводить метилирование органических соединений, используя повышенные температуры при атмосферном давлении (для сравнения, температура кипения метилиодида ниже 40 °С). Серьезным недостатком диметилсульфата является его высокая токсичность.
Метиловые эфиры аренсульфокислот имеют достоинства диметилсульфата, но менее токсичны, поэтому их использование в качестве N-метилирующего средства в ряде случаев является более рациональным. Обычно процесс ведут начиная при 25—26 °С и заканчивая при 70 °С:
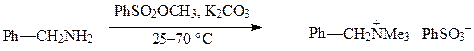
Непредельные соединения,взаимодействующие с аминами и азотистыми гетероциклами, также нередко используются в качестве алкилирующего агента в синтезе лекарственных соединений. Механизм реакции обычно рассматривают как нуклеофильное присоединение (AN) по p-связи.
Так, в синтезе анатруксония пиперидин алкилируют малоактивным алкеном — аллиловым спиртом:
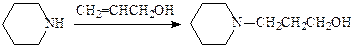
При получении диазолина используется активный метилакрилат, что позволяет при необходимости ввести в молекулу амина сразу два радикала:
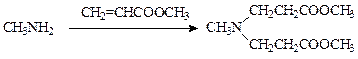
Даже слабые нуклеофилы — амиды карбоновых кислот — алкилируются непредельными соединениями. Так, в синтезе пантотената кальция фталимид алкилируют акрилонитрилом в присутствии этилата натрия или 1 %-ного спиртового раствора едкого натра:
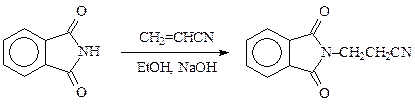
Метилирование аминов по Эшвайлеру-Кларку(формальдегидом в среде муравьиной кислоты) можно изобразить следующей схемой:
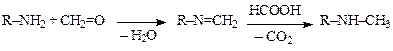
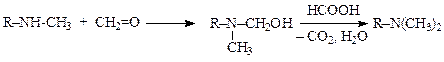
Процесс идет в два этапа. На первом образуются азометины или гидроксиметилпроизводные аминов, на втором продукты взаимодействия первичного и вторичного амина с формальдегидом восстанавливаются муравьиной кислотой до вторичного и третичного амина.
Выход продукта высокий, иногда достигает 100 %. С помощью этого метода можно метилировать многие амины, в том числе, аминокислоты и гетероциклические амины при температурах около 100 °С.
Однако процесс алкилирования по Эшвайлеру-Кларку длительный, для его завершения требуется до 10—15 часов, «дорогой», используется агрессивная среда и токсичные вещества. Ароматические амины метилируются лишь при наличии орто- и пара-заместителей, препятствующих гидроксиметилированию ароматического ядра. В связи с этим он используется тогда, когда другие способы не дают хороших результатов, как правило, при наличии в молекуле нескольких нуклеофильных центров.
Этим методом метилируют 6-метилпиперидин-2-карбоновую кислоту (в производстве димеколина):
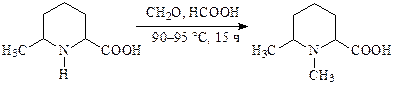
Во всех случаях выход продукта составляет около 90 %.
При этом метод позволяет целенаправленно, не затрагивая другие нуклеофильные центры, вводить в субстрат одну, две и более метильных групп. Например, при алкилировании 3-аминопропанола (синтез аминазина и пропазина):
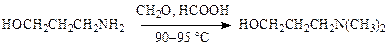
При получении гидрохлорида диметилглицина (в синтезе витамина В15) метод Эшвайлера-Кларка также дает хороший выход, однако лучше идти другим путем, с использованием более дешевого и доступного сырья:
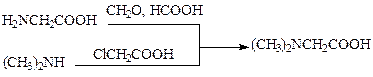
Замена формальдегида другими альдегидами и кетонами приводит к алкилированию аминов. Этот процесс обычно называют реакцией Лейкарта-Валлаха. В связи с тем, что карбонильные соединения и, особенно, кетоны менее реакционноспособны, чем формальдегид, алкилирование идет при более высоких температурах, чем метилирование.
Спирты в качестве N-алкилирующих агентов обычно используют в реакциях с ароматическими аминами.
В жидкой фазе процесс проводят в присутствии минеральных кислот в автоклавах под давлением выше 3 МПа, температуре 180—220 °С и в течение до 10 часов.
Так получают диметиланилин из анилина, метилового спирта и серной кислоты (при использовании метилиодида — 125 °С, 1 МПа, 10 час).
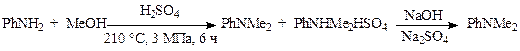
В качестве побочного продукта образуется некоторое количество соли четвертичного аммониевого основания. Для разложения соли реакционную массу нагревают в автоклаве с раствором едкого натра.
Каталитическая роль кислоты заключается в протонировании спирта и образовании хорошо уходящей группы. Вода либо вытесняется нуклеофилом (SN2-механизм), либо отщепляется, образуя карбокатион, который реагирует с ароматическим амином (SN1-механизм):
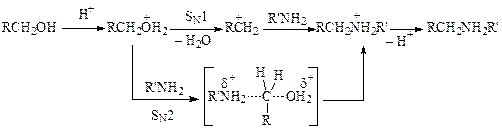
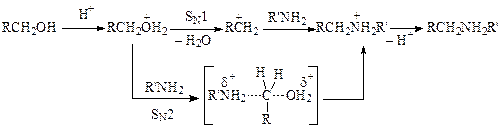
Природа минеральной кислоты заметно влияет на скорость протекания реакции. Так, при алкилировании анилина избытком этилового спирта (под давлением при 180—200 °С) в присутствии соляной кислоты получается смесь продуктов, содержащая значительное количество моноэтиланилина. При использовании бромоводородной кислоты в тех же условиях образуется в основном диэтиланилин. Однако чаще всего используют более дешевые серную и соляную кислоты. Серную кислоту загружают из расчета до 0,3 моль, а соляную до 1 моль на моль амина.
Спирт для алкилирования берется в избытке. При получении третичных аминов этот избыток больше (до 160 % от теории), при получении вторичных — меньше.
В паровой фазе алкилирование ароматических аминов спиртами проводят при температуре 300—400 °С в присутствии окиси алюминия в качестве катализатора.
В синтезах химико-фармацевтических препаратов алкилирование аминов спиртами имеет меньшее значение, чем другими реагентами. В качестве примера можно привести реакцию 1-фенил-2-пропанамина с гидроксиацетонитрилом в производстве сиднофена:
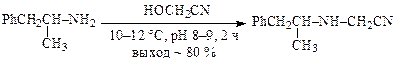
N-Алкилирование простыми эфирамиосуществляют в газовой фазе при температуре 250—350 °С. Смесь паров амина и эфира пропускают через слой катализатора (Al2O3, ThO2, TiO2, ZrO2).
Практический интерес представляет реакция анилина с метиловым эфиром, который является побочным продуктом в производстве метилового спирта:
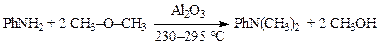
В промышленной установке избыток паров метилового эфира смешивают в испарителе с парами анилина. Смесь паров поступает в контактный аппарат трубчатого типа, где на 94—96 % превращается в диметиланилин. После отделения метанола смесь аминов с метиловым эфиром поступает во второй контактный аппарат, после которого степень превращения анилина в диметиланилин достигает 99,5—99,6 % от теоретического. Общий выход диметиланилина с учетом потерь на других стадиях производства составляет 97,6 %. В качестве катализатора используется активированная окись алюминия. Катализатор работает без замены 5 лет. Этого удалось достичь благодаря применению испарителя с циркуляцией анилина при неполном его испарении. Установка производительностью 5000 тонн диметиланилина в год автоматизирована и обслуживается всего двумя рабочими в смену. Коррозия в производстве диметиланилина парофазным методом практически отсутствует, а потому вся аппаратура выполнена из обычной углеродистой стали.
