Швидкість хімічної реакції визначається кількістю речовини, що прореагувала за одиницю часу в одиниці об’єму. Чинники, що впливають на швидкість хімічної реакції
Білет 1
1. Амфотерні гідроксиди – гідрати амфотерних оксидів, які мають слабкі кислотні та основні властивості.
Be(OH)2-,берилій 2 гідроксид
Zn(OH)2-цинк гідроксид
Pb(OH)2-плюмбум 2 гідроксид
Al(OH)3-алюміній гідроксид
Основні хімічні властивості амфотерних гідроксидів. Амфотерні гідроксиди взаємодіють з кислотами та кислотними оксидами, виявляючи основні властивості і утворюючи при цьому солі, наприклад:
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O;
2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O.
Амфотерні гідроксиди взаємодіють з основами та основними оксидами з утворенням солей, виявляючи при цьому кислотні властивості, наприклад:
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O (при сплавлянні);
Zn(OH)2 + CaO = CaZnO2 + H2O;
Al(OH)3 + 3NaOH = Na3[Al(OH)6] (у розчині).
Прояв амфотерності гідроксидів у водних розчинах зводиться до утворення комплексних сполук (гідроксокомплексів), а в твердофазних системах - цинкатів, мета - і ортоалюмінатів та інші. Вони здатні частково дисоціювати як основи і як кислоти. Наприклад: Al(OH)3 = Al + 3OH
Al(OH)3 = 3H + AlO3
2.Омос. Осмотичний тиск.Осмос— спонтанний перехід, однобічна дифузія через напівпроникну перегородку (мембрану), яка відокремлює розчин від чистого розчинника або розчину меншої концентрації.
Осмоти́чний ти́ск — термодинамічний параметр, що характеризує прагнення розчину понизити свою концентрацію при зіткненні з чистим розчинником внаслідок зустрічної дифузії молекул розчинника та розчиненої речовини н
3. Швидкість хімічних реакцій та чинники, що на них впливають.
Швидкість хімічної реакції визначається кількістю речовини, що прореагувала за одиницю часу в одиниці об’єму. Чинники, що впливають на швидкість хімічної реакції
1) Природа реагуючих речовин.
2) Агрегатний стан реагуючих речовин.
3) Концентрація реагуючих речовин.
Основний закон хімічної кінетики —закон діючих мас для швидкості хімічних реакцій: швидкість хімічної реакції за сталої температури пропорційна добутку концентрацій реагуючих речовин.
4) Площа поверхні зіткнення реагуючих речовин.
Ця залежність справедлива для гетерогенних систем за участю твердих речовин.
5) Зміна температури.
Залежність швидкості реакції від температури описуєтьсяправилом Вант-Гоффа: при підвищенні температури на кожні 10 °С швидкість більшості реакцій збільшується у 2—4 рази.
6) Для газів — тиск у системі.
7) Наявність каталізаторів.
Каталізатори — це речовини, що змінюють швидкість хімічної реакції. Каталізатор у процесі реакції не витрачається і до складу кінцевих продуктів не входить.Позитивний каталіз — прискорення реакції.Негативний каталіз,абоінгібування,— уповільнення реакції.
Білет 2
1. . Закон Вант-Гоффа.При збільшенні температури на кожні 10 градусів константа швидкості гомогенної елементарної реакції збільшується в два-чотири рази.
2. Метали - прості речовини, що володіють в звичайних умовах характерними властивостями: високими електропровідністю і теплопровідністю, здатністю добре відображати світло (що обумовлює їх блиск і непрозорість), можливістю приймати потрібну форму під впливом зовнішніх сил. Місце елементів-металів у Періодичній системі хімічних елементів Д. І. Менделєєва та особливості будови їх атомів. Металічний хімічний зв'язок. Загальні фізичні властивості металів. Метали мають величезне значення в розвитку людської цивілізації. З давніх-давен людству відомі золото, срібло, мідь та залізо. Сучасна металургія отримує для потреб техніки більше 60 металів та на їх основі понад 5000 сплавів. Розглянемо положення елементів-металів у Періодичній системі хімічних елементів Д. І. Менделєєва. Якщо провести лінію від Бору до Астату, то можна помітити, що усі елементи, розташовані лівіше від проведеної лінії, відносять до металічних. Правіше цієї межі розміщені переважно елементи-неметали та деяка частина d-елементів, які належать до так званих перехідних металів (наприклад, Хром, Ферум, Платина). Бачимо, що переважна більшість відомих хімічних елементів є металічними.Атоми елементів-металів на зовнішньому енергетичному рівні містять невелику кількість електронів — від одного до трьох, зрідка — чотири. Намагаючись набути стійкої електронної конфігурації інертних газів, металічні елементи легко віддають електрони, утворюючи катіони. Чим менше електронів міститься на зовнішньому енергетичному рівні і чим більший радіус атома, тим легше атом металічного елемента перетворюється на відповідний катіон. За цієї причини в періодах при збільшенні заряду атомного ядра, металічні властивості зменшуються, а в групах — збільшуються. Метали є речовинами немолекулярної будови. Оскільки атоми елементів-металів здатні віддавати електрони з зовнішнього енергетичного рівня, то у вузлах кристалічної ґратки металів містяться позитивні йони і деяка частина нейтральних атомів. Між ними хаотично пересуваються відносно вільні електрони, які стають спільними для всієї кристалічної ґратки. Таку кристалічну ґратку називають металічною. Усуспільнені електрони, вільно пересуваючись, компенсують сили електростатичного відштовхування між позитивно зарядженими йонами і, таким чином, забезпечують хімічний зв’язок в кристалі металу. Зв’язок, який здійснюють відносно вільні електрони між катіонами металів кристалічної ґратки називають металічним.
3.Зако́н Рау́ля — парціальні тиски рі пари кожного з компонентів ідеального розчину при постійній температурі є пропорційними до молярних часток цих компонентів в рідкій фазі 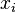 :
:
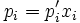 ,
,
де 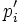 — пружність пари чистого розчинника.
— пружність пари чистого розчинника.
Закон установив Франсуа Марі Рауль.
Залежність зниження тиску пари розчинів від їхньої концентрації виражається першим законом Рауля (1887): відносне зниження тиску насиченої пари над розчином прямопропорційне мольній частці розчиненої речовини.
Другий закон Рауля: підвищення температури кипіння, або зниження температури замерзання розчину прямопропорційне моляльнійконцентрації розчиненої речовини. Коефіцієнти пропорційності називають відповідно ебуліоскопічна і кріоскопічна сталі. Значення коефіцієнтів залежать лише від природи розчинника.
Білет 3
1. Хімічна кінетика — розділ хімії, що вивчає швидкість хімічних процесів. Ця наука включає в себе вивчення впливу різних експериментальних умов на швидкість хімічних реакцій та досліджує їх механізми, що включає в себе знаходження також і характеризацію перехідного стану.
- 2. Хімічні властивості металів.
Метали займають в Періодичній таблиці лівий нижній кут. Метали відносяться до сімейств s - елементів, d - елементів, f-елементів і частково - р-елементів.
Найтиповішим властивістю металів є їх здатність віддавати електрони і переходити в позитивно заряджені іони. Причому метали можуть виявляти тільки позитивну ступінь окислення.
Ме - ne = Me n +
1. Взаємодія металів з неметалами.
а). Взаємодія металів з воднем.
З воднем безпосередньо реагують лужні і лужноземельні метали, утворюючи гідриди. Наприклад:
2Na + H 2 = NaH
Ca + H 2 = CaH 2
Утворюються нестехіометричних з'єднання з іонною кристалічною структурою.
б). Взаємодія металів з киснем.
Всі метали за винятком Au, Ag, Pt окисляються киснем повітря. Приклад:
2Na + O 2 = Na 2 O 2 (пероксид)
4K + O 2 = 2K 2 O
2Mg + O 2 = 2MgO
2Cu + O 2 = 2CuO
в). Взаємодія металів з галогенами.
Всі метали реагують з галогенами з утворенням галогенідів. Приклад:
2Al + 3Br 2 = 2AlBr 3
В основному це іонні з'єднання: MeHal n
г). Взаємодія металів з азотом.
З азотом взаємодіють лужні і лужноземельні метали. Приклад:
3Ca + N 2 = Ca 3 N 2
Mg + N 2 = Mg 3 N 2 - нітрид.
д). Взаємодія металів з вуглецем.
Сполуки металів і вуглецю - карбіди. Вони утворюються при взаємодії розплавів з вуглецем. Активні метали утворюють з вуглецем стехіометричні сполуки:
4Al + 3C = Al 4 C 3
Метали - d-елементи утворюють сполуки нестехиометрического складу типу твердих розчинів: WC, ZnC, TiC - використовуються для одержання надтвердих сталей.
3. Осмос, осмотичний тиск. Закон Вант-Гоффа для осмосу.
. Закон Вант-Гоффа.При збільшенні температури на кожні 10 градусів константа швидкості гомогенної елементарної реакції збільшується в два-чотири рази.Осмос— спонтанний перехід, однобічна дифузія через напівпроникну перегородку (мембрану), яка відокремлює розчин від чистого розчинника або розчину меншої концентрації.
Осмоти́чний ти́ск — термодинамічний параметр, що характеризує прагнення розчину понизити свою концентрацію при зіткненні з чистим розчинником внаслідок зустрічної дифузії молекул розчинника та розчиненої речовини.
Білет 4
1.Стехіометрія - розділ хімії про співвідношення реагентів в хімічних реакціях.
Дозволяє теоретично обчислювати необхідні маси та об'єми реагентів.В основі стехіометрії лежать закони збереження маси , еквівалентів , Авогадро , Гей-Люссака , сталості складу , кратних відносин . Всі закони стехіометрії обумовлені атомно-молекулярною будовою речовини.Відносини кількостей реагентів , рівні відносинам коефіцієнтів у стехіометричному рівнянні реакції , називаються стехіометричними . Якщо речовини реагують у співвідношенні 1:1 , то їхні відповідні кількості називають еквімолярними.Речовини, для яких спостерігаються відхилення від законів стехіометрії , звуться нестехіометричними . Відхилення від законів стехіометрії спостерігаються для конденсованих фаз і пов'язані з утворенням твердих розчинів (для кристалічних речовин), з розчиненням в рідині надлишку компонента реакції або термічною дисоціацією з'єднання, що утворюється (в рідкій фазі, в розплаві) . Закони стехіометрії використовують у розрахунках, пов'язаних з формулами речовин і знаходженням теоретично можливого виходу продуктів реакції[1].
2.Зако́н Авога́дро — однакові об'єми будь-яких газів при однаковому тиску і температурі містять однакову кількість молекул. Цей закон був відкритий італійським фізиком Амедео Авогадро в 1811 році.
Наслідок закону Авогадро: однакові кількості молекул різних газів при однаковій температурі і однаковому тиску займають однакові об'єми. Так як 1 моль будь-яких газів містить однакову кількість молекул — 6,02 • 1023, це число називають сталою Авогадро і позначають 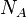 .
.
Об'єм, який займає один моль будь-якого газу при нормальних умовах, називається молярним об'ємом (позначається Vm). Нормальними (скорочено н. у.) називаються такі умови, коли температура дорівнює 0 °C, а тиск 1 ат., або 760 мм рт. ст. Молярний об'єм усіх газів незалежно від їх маси однаковий і дорівнює 22,4 дм3 (22,4 л).
3. Розчини – це гомогенні (однорідні) системи, що складаються з двох і більше компонентів і продуктів їх взаємодії.
Концентрація речовини – це величина, що вимірюється кількістю розчиненої речовини, що міститься у певній масі чи об’ємі розчину або розчинника.
Білет 5
1. Хімічна рівновага. Принцип Ле-Шательє.
Хімічна рівновага –стан оборотної реакції, у якому швидкість прямої реакції та зворотної реакції однакові
А+В ↔ С+Д
Vпрямої р-ції = Vзворотної р-ції.Принцип Лешательє-Брауна[1] стверджує, що реакція рівноважної термодинамічної системи на будь-яке збурення відбувається таким чином, щоб зменшити наслідки цього збурення.
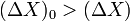 ,
,
де 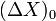 - величина того відклику, яка спостерігалася б при зафіксованому стані системи,
- величина того відклику, яка спостерігалася б при зафіксованому стані системи, 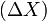 - справжня величина відклику, коли система реагує на збурення зміною свого стану.
- справжня величина відклику, коли система реагує на збурення зміною свого стану.
2.Каталіз (від грец. κατάλυσις — розпад) — зміна швидкостей хімічних реакцій чи їх збудження внаслідок дії речовин (каталізаторів), які беруть участь у процесах, однак не входять до складу кінцевих продуктів. Зазвичай під терміном каталіз розуміють явище, коли в присутності каталізатора відбувається «позитивний каталіз», тобто збільшення швидкості реакції.
Каталізатор може багаторазово брати участь у хімічних взаємодіях, у кількості набагато меншій за кількість реагуючих речовин. Також застосовуються речовини, що сповільнюють хід реакції — інгібітори або антикаталізатори.
3. 2. Хімічні властивості металів.
Метали займають в Періодичній таблиці лівий нижній кут. Метали відносяться до сімейств s - елементів, d - елементів, f-елементів і частково - р-елементів.
Найтиповішим властивістю металів є їх здатність віддавати електрони і переходити в позитивно заряджені іони. Причому метали можуть виявляти тільки позитивну ступінь окислення.
Ме - ne = Me n +
1. Взаємодія металів з неметалами.
а). Взаємодія металів з воднем.
З воднем безпосередньо реагують лужні і лужноземельні метали, утворюючи гідриди. Наприклад:
2Na + H 2 = NaH
Ca + H 2 = CaH 2
Утворюються нестехіометричних з'єднання з іонною кристалічною структурою.
б). Взаємодія металів з киснем.
Всі метали за винятком Au, Ag, Pt окисляються киснем повітря. Приклад:
2Na + O 2 = Na 2 O 2 (пероксид)
4K + O 2 = 2K 2 O
2Mg + O 2 = 2MgO
2Cu + O 2 = 2CuO
в). Взаємодія металів з галогенами.
Всі метали реагують з галогенами з утворенням галогенідів. Приклад:
2Al + 3Br 2 = 2AlBr 3
В основному це іонні з'єднання: MeHal n
г). Взаємодія металів з азотом.
З азотом взаємодіють лужні і лужноземельні метали. Приклад:
3Ca + N 2 = Ca 3 N 2
Mg + N 2 = Mg 3 N 2 - нітрид.
д). Взаємодія металів з вуглецем.
Сполуки металів і вуглецю - карбіди. Вони утворюються при взаємодії розплавів з вуглецем. Активні метали утворюють з вуглецем стехіометричні сполуки:
4Al + 3C = Al 4 C 3
Метали - d-елементи утворюють сполуки нестехиометрического складу типу твердих розчинів: WC, ZnC, TiC - використовуються для одержання надтвердих сталей.
Білет 6
1. Коро́зія металів — процес хімічного руйнування металів і сплавів при їх взаємодії з зовнішнім середовищем: повітрям, водою, розчинами електролітів тощо. Розрізняють два види корозії: хімічну і електрохімічну. Корозія металів відбувається безперервно і завдає величезних збитків. Підраховано, що прямі втрати заліза від корозії становлять близько 10 % його щорічної виплавки. Внаслідок корозії металеві вироби втрачають свої цінні технічні властивості. Тому важливе значення мають методи захисту металів та сплавів від корозії. Вони досить різноманітні. Назвемо деякі з них.
Захисні поверхневі покриття металів. Вони бувають металічними (покриття цинком, оловом, свинцем, нікелем, хромом та іншими металами) і неметалічними (покриття лаком, фарбою, емаллю та іншими речовинами). Ці покриття ізолюють метал від зовнішнього середовища. Так, покрівельне залізо покривають цинком; з оцинкованого заліза виготовляють численні вироби побутового та промислового призначення. Шар цинку запобігає корозії заліза, бо цинк, хоча й більш активний метал, ніж залізо (див. ряд стандартних електродних потенціалів металів, вкритий оксидною плівкою. В разі пошкодження захисного шару (подряпини, пробої дахів тощо) за наявності вологи виникає гальванічна пара Zn | Ре. Катодом (позитивним полюсом) є залізо, анодом (негативним полюсом) — цинк (рис. 12.6). Електрони переходять від цинку до заліза, де зв'язуються молекулами кисню (киснева деполяризація), цинк розчиняється, а залізо залишається захищеним доти, доки не зруйнується весь шар цинку, що потребує досить багато часу. Покриття залізних виробів нікелем, хромом,
крім захисту від корозії, надає їм красивого зовнішнього вигляду.
2. При збільшенні температури на кожні 10 градусів константа швидкості гомогенної елементарної реакції збільшується в два-чотири раз
3.
Хімічна рівновага –стан оборотної реакції, у якому швидкість прямої реакції та зворотної реакції однакові
А+В ↔ С+Д
Білет 7
1. Закон збереження енергії - закон, який стверджує, що повна енергія в ізольованих системах не змінюється з часом. Проте енергія може перетворюватися з одного виду в інший. У термодинаміці закон збереження енергії відомий також під назвою першого закону термодинаміки. Закон збереження енергії є, мабуть, найважливішим із законів збереження, які застосовуються в фізиці.
Закон збереження маси:маса речовин, що вступають у хімічну реакцію, дорівнює масі речовин, що утворюються внаслідок реакції.
2. Швидкість хімічної реакції - швидкість, з якою утворюються її продукти або витрачаються реагенти. Вивчаючи хімію та спостерігаючи явища повсякденного життя, ви неодноразово пересвідчувалися, що хімічні реакції відбуваються з різною швидкістю.
Хімічна кінетика — розділ хімії, що вивчає швидкість хімічних процесів. Ця наука включає в себе вивчення впливу різних експериментальних умов на швидкість хімічних реакцій та досліджує їх механізми, що включає в себе знаходження також і характеризацію перехідного стану. Інтенсивність проходження хімічних реакцій визначається швидкістю, тобто зміною концентрації реагуючої речовини або продукту реакції за одиницю часу:
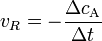
де С – молярна концентрація реагуючої речовини, а t – час. Мінус перед правим членом обумовлений зниженням концентрації реагуючої речовини в ході реакції. У виразі швидкості реакції за зміною концентрації продукту реакції мінус не ставиться. Отже, швидкість рекції завжди позитивна.
3. Хімічна рівновага - стан хімічної системи, в якому оборотно протікає одна або кілька хімічних реакцій, причому швидкості в кожній парі пряма-зворотна реакція рівні між собою. Для системи, що перебуває в хімічному рівновазі, концентрації реагентів, температура і інші параметри системи не змінюються з часом.[1]
А 2 + В 2 ⇄ 2AB
Білет 8
1. Закон сталості складу ( Ж.Л.Пруст, 1801 - 1808гг.) - будь-яка визначена хімічно чисте з'єднання незалежно від способу його одержання складається з одних і тих же хімічних елементів, причому відносини їх мас постійні, а відносні числа їх атомів виражаються цілими числами. Це один з основних законів хімії.
Закон сталості складу не виконується для бертоллідов (сполук змінного складу). Однак умовно для простоти складу багатьох бертоллідов записують як постійний. Наприклад, склад оксиду заліза (II) записують у вигляді FeO (замість більш точної формули Fe 1-x O).Закон кратних відношень – якщо два елементи, що реагують між собою, утворюють декілька сполук, то різні масові кількості одного елемента, що сполучаються з однією і тією ж масовою кількістю другого, відносяться як невеликі цілі числа. Даний закон сформульовано в 1803 році Джоном Дальтоном. Відтак, елементи завше з'єднуються між собою в певних масових кількостях, що відповідають їх еквівалентам.
2. Ковалентний зв’язок— це хімічний зв’язок, який здійснюється між атомами за рахунок електронних пар, що однаковою мірою належать обом атомам. Ковалентний зв’язок, утворений однаковими атомами (з однаковою електронегативністю), називаєтьсянеполярним, а утворений різними атомами (з різною електронегативністю), —полярним.
Електрони, здатні брати участь в утворенні хімічного зв’язку, називаютьсявалентними. Їх кількість визначає число зв’язків, що утворюються атомом, тобто
валентність.
3.. Коро́зія металів — процес хімічного руйнування металів і сплавів при їх взаємодії з зовнішнім середовищем: повітрям, водою, розчинами електролітів тощо. Розрізняють два види корозії: хімічну і електрохімічну. Корозія металів відбувається безперервно і завдає величезних збитків. Підраховано, що прямі втрати заліза від корозії становлять близько 10 % його щорічної виплавки. Внаслідок корозії металеві вироби втрачають свої цінні технічні властивості. Тому важливе значення мають методи захисту металів та сплавів від корозії. Вони досить різноманітні. Назвемо деякі з них.
Захисні поверхневі покриття металів. Вони бувають металічними (покриття цинком, оловом, свинцем, нікелем, хромом та іншими металами) і неметалічними (покриття лаком, фарбою, емаллю та іншими речовинами). Ці покриття ізолюють метал від зовнішнього середовища. Так, покрівельне залізо покривають цинком; з оцинкованого заліза виготовляють численні вироби побутового та промислового призначення. Шар цинку запобігає корозії заліза, бо цинк, хоча й більш активний метал, ніж залізо (див. ряд стандартних електродних потенціалів металів, вкритий оксидною плівкою. В разі пошкодження захисного шару (подряпини, пробої дахів тощо) за наявності вологи виникає гальванічна пара Zn | Ре. Катодом (позитивним полюсом) є залізо, анодом (негативним полюсом) — цинк (рис. 12.6). Електрони переходять від цинку до заліза, де зв'язуються молекулами кисню (киснева деполяризація), цинк розчиняється, а залізо залишається захищеним доти, доки не зруйнується весь шар цинку, що потребує досить багато часу. Покриття залізних виробів нікелем, хромом,
крім захисту від корозії, надає їм красивого зовнішнього вигляду.
Білет 9
1. Зако́н Гей-Люсса́ка — назва двох законів, що описують властивості газів.
1) Закон теплового розширення газів: при сталому тискові залежність об'єму Vt даної маси газу від температури описується формулою:
Vt/T = const або
Vt=V0(1+ αt),
де V0 — об'єм газу при даному тискові і при температурі 273,15 К, t — температура (емпірична) за шкалою Цельсія, Т — термодинамічна температура, α — коефіцієнт об'ємного розширення газу (для інертних газів, водню і кисню, та дорівнює коефіцієнту об'ємного розширення ідеального газу α = 1/(273,15 К)).
2) Закон об'ємних відношень, за яким при постійних температурі і тиску об'єми газів, які вступають у реакцію, відносяться між собою і до об'ємів газоподібних продуктів реакції, як невеликі прості числа. Наприклад, при взаємодії одного об'єму водню з одним об'ємом хлору утворюється два об'єми хлористого водню.
Закон носить ім'я французького вченого Жозефа-Луї Гей-Люссака.
2. При́нцип Па́улі (принцип заборони Паулі, принцип виключення Паулі)— квантово-механічний принцип, згідно з яким у багаточастинковій системі невзаємодіючих ферміонів, ніякі дві частки не можуть описуватися хвильовими функціями з однаковим набором усіх квантових чисел.
Принцип сформульовано Вольфгангом Паулі 1925 року. Він є наслідком принципу нерозрізнюваності часток (або принципу тотожності частинок).
Ферміони характеризуються тим, що їхні хвильові функції антисиметричні щодо перестановки ідентичних частинок. Щоб забезпечити антисиметричність, хвильову функцію системи багатьох ферміонів зазвичай будують за допомогою детермінанта Слейтера, використовуючи певний набір одночастинкових хвильових функцій. Із цих одночастинкових функцій не може бути двох однакових, бо згідно з властивостямивизначника при двох однакових рядках чи стовпчиках визначник дорівнює нулю.
3. Водне́вий зв'язо́к — різновид хімічного зв'язку, що реалізується за донорно-акцепторним механізмом між двома ковалентно зв'язаними атомами з великим значенням електронегативності (О, N, F) за посередництвом атома Гідрогену Н.
Водневий зв'язок є прикладом трицентрового чотириелектронного зв'язку.
Прослідковується певна аналогія між водневим та ковалентним зв'язком. Зокрема, водневий зв'язок є направленим та насичуваним, що вказує на його резонансну природу (на противагу електростатичній природі йонного зв'язку). Висувається припущення, що йон H+ завдяки своїм унікальним властивостям (він фактично є єдиною частинкою — протоном) виступає аналогом електронної пари в класичному ковалентному зв'язку, тільки з протилежним знаком.
Білет 10
1. Каталіза́тор — речовина, яка змінює швидкість хімічних реакцій (найчастіше знижуючи її енергію активації), а сама після реакції залишається хімічно незмінною і в тій же кількості, що й до реакції.
На молекулярному рівні каталізатори вступають в реакцію в одних елементарних актах і відновлюються в інших. На практиці каталізатори зазнають змін внаслідок побічних процесів. Основними характеристиками каталізаторів є каталітична активність та селективність.
Каталізаторами можуть бути різні речовини і в різному агрегатному стані (твердому, рідкому та газоподібному). Каталізатори, що прискорюють реакції (в сотні і навіть тисячі разів) називаються позитивними. Ті ж, що уповільнюють реакції, називають негативними (інгібітори). Саме явище зміни швидкості хімічної реакції під впливом каталізатора називаютькаталізом, а реакції, що відбуваються під впливом каталізатора — каталітичними.
Каталіз - виборче прискорення одного з можливих термодинамічно дозволених напрямків хімічної реакції під дією каталізатора (ів), який багаторазово вступає в проміжне хімічна взаємодія з учасниками реакції і відновлює свій хімічний склад після кожного циклу проміжних хімічних взаємодій. [1]. Типи каталізу
Каталіз може бути позитивним (коли швидкість реакції збільшується) і негативним (коли швидкість реакції зменшується). Для позначення від'ємного каталізу часто використовують термін інгібування.
Каталіз буває гомогенним і гетерогенним (контактним). У гомогенному каталізі каталізатор складається в тій же фазі, що і реактиви реакції, в той час, як гетерогенні каталізатори відрізняються фазою.
Гомогенний каталіз
Прикладом гомогенного каталізу є розкладання пероксиду водню в присутності іонів йоду. Реакція протікає у дві стадії:
H 2 О 2 + I → H 2 О + IO
H 2 О 2 + IO → H 2 О + О 2 + I
При гомогенному каталізі дію каталізатора пов'язано з тим, що він вступає у взаємодію з реагують речовинами з утворенням проміжних сполук, це призводить до зниження енергії активації.
Гетерогенний каталіз
При гетерогенному каталізі прискорення процесу зазвичай відбувається на поверхні твердого тіла - каталізатора, тому активність каталізатора залежить від величини і властивостей його поверхні. На практиці каталізатор зазвичай наносять на твердий пористий носій.
Механізм гетерогенного каталізу складніше, ніж у гомогенного. Механізм гетерогенного каталізу включає п'ять стадій, причому всі вони оборотні.
1. Дифузія реагуючих речовин до поверхні твердої речовини
2. Фізична адсорбція на активних центрах поверхні твердого речовини реагують молекул і потім хемосорбция їх
3. Хімічна реакція між реагують молекулами
4. Десорбція продуктів з поверхні каталізатора
5. Дифузія продукту з поверхні каталізатора в загальний потік
Прикладом гетерогенного каталізу є окислення SO 2 в SO 3 на каталізаторі V 2 O 5 при виробництві сірчаної кислоти (контактний метод).
