Вивчення властивостей глюкози
Лабораторна робота №7
Тема. Вивчення властивостей моно – та дисахаридів.
Мета:закріпити навики проведення хімічних реакцій між органічними речовинами, довести хімічну природу глюкози , провести реакцію окислення глюкози, гідролізу цукрози та виявити її мономерний склад
Прилади та реактиви: розчини глюкози(C6H12O6) ,фруктози (C6H12O6), цукрози(C12H22O11), мальтози(C12H22O11), розчин купрум(ІІ) сульфату(CuSO4) , розчин натрій гідроксиду(NaOH), реактив Фелінга, реактив Селіванова, розчин соляної кислоти
( HCl) , штатив з пробірками, тримачі
Вуглеводи – це полі гідроксильні альдо -, або кето спирти.
Із моносахаридів найбільше значення має глюкоза, яку ще називають виноградним цукром. Глюкоза міститься у великих кількостях у виноградному соку, меді, а також у спілих фруктах і ягодах. Це біла кристалічна речовина, добре розчинна у воді, солодка на смак. Назва «глюкоза» утворена від грецького слова глюкос, що означає «солодкий».
Молекулярна формула глюкози С6Н12О6. її будову визначено на основі вивчення властивостей. Так, глюкоза виявляє властивості багатоатомних спиртів і альдегідів. Якщо до розчину глюкози влити гідроксид міді (II), то він набуває яскраво-синього забарвлення, подібно до того, як це відбувається з гліцерином. Якщо підігріти яскраво-синій розчин, який добули, з'являється червоний осад, який свідчить про наявність альдегідної групи.
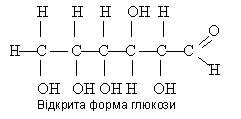 Доведено, що в молекулі глюкози є альдегідна група і п'ять гідроксильних груп. Отже, глюкоза — це альдегідоспирт, її молекула має таку будову:
Доведено, що в молекулі глюкози є альдегідна група і п'ять гідроксильних груп. Отже, глюкоза — це альдегідоспирт, її молекула має таку будову:
Однак її не всі властивості глюкози узгоджуються з її будовою як альдегідоспирту. Деяких реакцій, характерних для альдегідів, глюкоза не дає. Справа в тому, що глюкоза є сполукою з мішаною функцією, її природа ускладнюється можливістю внутрішїіьомолекулярних взаємодій гідроксильної групи з карбонільною групою, завдяки чому глюкоза існує не тільки у відкритій ланцюговій формі, айв циклічних α- та |β-формах, які відрізняються розміщенням гідроксильних груп відносно площина кільця. Циклічну будову молекула глюкози має у кристалічному стані, у водних же розчинах вона існує у двох різних формах, які взаємно переходять одна в одну:
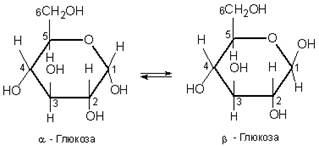
Хімічні властивості глюкози обумовлені наявністю гідроксильних і альдегідної груп. Тому глюкоза вступає в реакції, характерні для спиртів і альдегідів.
Глюкоза подібно до альдегідів може відновлюватись, перетворюючись на шестиатомний спирт — сорбіт.
СН2(ОН)-(СН(ОН))4-СНО +Н2→ СН2(ОН)-(СН(ОН))4- СН2(ОН)
Сорбіт вперше був виділений з плодів горобини. Він приблизно вдвічі менш солодкий, ніж звичайний цукор. Сорбіт не підвищує вмісту глюкози в крові, тому його використовують замість Цукру в харчуванні людей, хворих на цукровий діабет.
Як альдегід глюкоза легко окиснюється. Вона вступає в реакцію «срібного дзеркала», окиснюючись до глюконової кислоти.
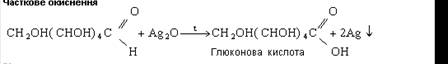
Глюкоза окиснюється гідроксидом міді (II) під час кипіння також до глюконової кислоти.
2HOСН2-(СНOH)4)-СН=O + Cu(OH)2→
2HOСН2-(СН(OH))4-СOOH + Cu2O↓ + 2H2O
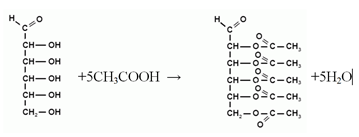
Як багатоатомний спирт глюкоза вступає в реакції естерифікації з органічними кислотами і утворює естери.
Одна молекула глюкози взаємодіє з п'ятьма молекулами оцтової кислоти, що підтверджує наявність у молекулі глюкози п'яти спиртових гідроксигруп.
За участю гідроксильних груп відбувається взаємодія глюкози з гідроксидами металів з утворенням сахаратів.
HOСН2-(СН(OH)4)-СН=O + Cu(OH)2 →
HOСН2- (СН(OH))2 (СН(OH)2 Cu) -СН=O
При взаємодії глюкози з гідроксидом міді (II) утворюється сахарат міді — сполука синього кольору. Цю реакцію використовують для виявлення цукру в сечі.
Велике значення мають процеси бродіння глюкози, які відбуваються під дією органічних каталізаторів — ферментів (вони виробляються мікроорганізмами). Відомо кілька видів бродіння.
Спиртове бродіння відбувається під дією ферментів дріжджів.
C6Н12О6→ 2C2Н5ОH +2CO2↑ +23,5∙104дж
Молочнокисле бродіння глюкози відбувається під молочнокислих бактерій:
C6Н12О6→2CН3СОH-СООН +21,8∙104дж
Молочна кислота утворюється при скисанні молока, квашенні капусти, огірків, силосуванні зелених кормів.
Глюкоза — цінна поживна речовина. При окисненні її у тканинах вивільнюється енергія, необхідна для нормальної життєдіяльності організму.
В обміні речовин глюкоза займає центральне місце, оскільки є енергетичним «паливом» для численних процесів, що відбуваються в клітинах організму. Глюкоза — необхідний компонент крові, її вміст у крові людини становить 80—120 мг в 100 мл. Коли вміст глюкози у крові становить більше ніж 180 мг, порушується вуглеводневий обмін, виникає хвороба діабет.
У зв'язку з тим, що глюкоза легко і швидко засвоюється, її застосовують як засіб посиленого харчування, а також для виготовлення лікувальних препаратів, при консервуванні крові. Вона широко використовується в кондитерському виробництві, у виробництві дзеркал та іграшок (сріблення). Нею користуються при обробці й фарбуванні тканин і шкір.
У промисловості глюкозу добувають із більш складного вуглеводню — крохмалю.
До моносахаридів належить і фруктоза С6Н12О6 , або, як її називають, плодовий цукор. Це ізомер і супутник глюкози у багатьох плодових і ягідних соках.
На відміну від глюкози фруктоза е кетоноспиртом, до її складу входить функціональна кетонна група:
|
Фруктоза значно солодша за глюкозу, у суміші з нею входить до складу меду. Фруктоза — найкращий вид цукру для хворих атеросклерозом, при порушенні в організмі обміну жирів.
Сахароза (звичайний цукор) — біла кристалічна речовина, солодша за глюкозу, добре розчинна у воді. Важлива хімічна властивість сахарози — здатність до гідролізу (при нагріванні і наявності іонів водню як каталізатора). При цьому з однієї молекули сахарози утворюється молекула глюкози й молекула фруктози:
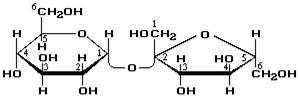
Це підтверджує, що молекули сахарози складаються із сполучених один з одним залишків молекул глюкози і фруктози. Сахарозу порівняно з глюкозою можна розглядати ніби подвійним цукром, через що вона й належить до дисахаридів (грецьке слово ди означає «двічі»),
Утворення дисахаридів можна уявити собі як процес, зворотний їх гідролізу:
С12Н22О11 + Н2О→ С6Н12О6 ( глюкоза) + С6Н12О6 (фруктоза)
Сахароза не дає реакції «срібного дзеркала» і не має відновних властивостей. У цьому її відмінність від глюкози. В той же час вона, як і глюкоза, легко взаємодіє з гідроксидами металів.
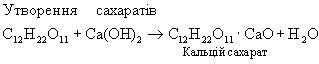
Так, суспензія гідроксиду кальцію розчиняється у розчині сахарози з утворенням сахарату кальцію, подібного за будовою до сполуки глюкози з кальцієм.
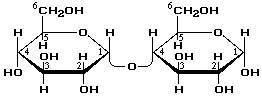
Мальтоза – ізомер сахарози , що складається з двох залишків α глюкози
Хід роботи
Вивчення властивостей глюкози.
1.1.Реакції глюкози, як багатоатомного спирту
В пробірку налийте 1-1,5мл глюкози, додайте купрум(ІІ) гідроксиду, добутого таким чином: до розведеного розчину купрум сульфату долити надлишок натрій гідроксиду. Злити надлишок рідини з купрум гідроксиду до осаду ,що залишився додати 2-3 мл води і збовтати. Запишіть рівняння реакції, спостереження та висновки.
1.2. Реакції глюкози, як альдегіду
В пробірку налийте невелику кількість розчину глюкози, додайте реактиву Фелінга , затисніть пробірку в тримачі і обережно нагрівайте до зміни забарвлення. Запишіть рівняння реакції, спостереження та висновки..
Дослід 2.Вивчення властивостей фруктози, як кетоноспирту
В пробірку налийте невелику кількість розчину фруктози, додайте реактиву Селіванова , затисніть пробірку в тримачі і обережно нагрівайте до зміни забарвлення .Запишіть рівняння реакції, спостереження та висновки..
Дослід 3 Інверсія цукрози
В пробірку налийте невелику кількість розчину цукрози, додайте розчину соляної кислоти( обережно!),затисніть пробірку в тримачі і обережно нагрівайте до зміни забарвлення .Запишіть рівняння реакції, спостереження та висновки.
