Приклади розв’язання задач. Приклад 1.Визначити величину електродного потенціалу металу Ni в розчині його соліз концентрацію = 0,05 моль/дм3
Приклад 1.Визначити величину електродного потенціалу металу Ni в розчині його соліз концентрацію 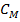 = 0,05 моль/дм3.
= 0,05 моль/дм3.
Розв’язок: Із таблиці стандартних електродних потенціалів знаходимо значення 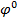 Ni/
Ni/ 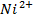 = -0, 25 В.табл. 3(додаток)
= -0, 25 В.табл. 3(додаток)
За рівнянням Нернста
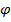 =
= 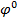 +
+ 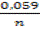 lgC
lgC
визначаємо потенціал нікелю в 0,05 М розчині його солі:
𝞿 = -0,25 + 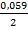 lg0,05 = -0,25 + 0,0295 · (-1,3) = -0,288 В
lg0,05 = -0,25 + 0,0295 · (-1,3) = -0,288 В
Концентрацію солі 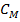 = 0,05 моль/
= 0,05 моль/ 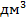 переводимо в степний вигляд та визначаємо логарифм
переводимо в степний вигляд та визначаємо логарифм
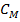 = 0,05 моль/
= 0,05 моль/ 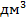 = 5 ·
= 5 · 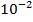 моль/
моль/ 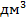
lg 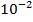 = lg5 + lg
= lg5 + lg 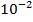 = 0,7 + (-2) = -1,35 ·
= 0,7 + (-2) = -1,35 ·
Відповідь:електродний потенціал нікелю в 0,05 М розчинні його солі становить 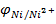 = -0,288 В.
= -0,288 В.
Приклад 2.Визначити анод та катод в наведеній схемі гальванічного елемента. Записати процеси на електродах та визначити електрорушильну силу елемента при стандартних умовах Zn|Zn 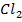 ||Co
||Co 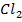 |Co.
|Co.
Розв’язок:
Знаходимо із ряду напруг металів стандартні електродні потенціали цинку та кобальту
(A-) Zn|Zn 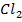 || Co
|| Co 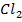 |Co (K+)
|Co (K+)
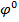 Zn/
Zn/ 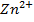 = -0,76 В
= -0,76 В 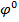 Co/
Co/ 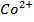 = -0,277 В
= -0,277 В
Визначаємо, що найменша величина електродного потенціалу у цинка, тобто він буде анодом як система з найменшим потенціалом.
На аноді відбувається окиснення металу, а на катоді відновлення йона металу.
Записуємо процеси на аноді та катоді
А -) Zn - 2 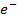 →
→ 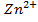 │ 1
│ 1
К +) 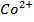 + 2
+ 2 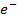 →
→ 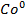 │ 1
│ 1
Zn + 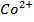 →
→ 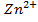 +
+ 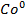 – сумарне йонне рівняння
– сумарне йонне рівняння
Zn + Co 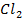 → Zn
→ Zn 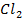 +
+ 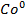 – молекулярне рівняння
– молекулярне рівняння
Розраховуємо електрорушильну силу елемента
𝜺 (EPC) = 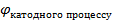 -
- 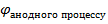
𝜺 = -0,277 – (-0,76) = 0,453 В.
Відповідь: в наведеній схемі гальванічного елемента цинк як система з найменшим потенціалом є анодом, кобальт – катод. Напруга гальванічного елемента становить 0,453 В.
Задача 3.
Приклад 3.Скласти рівняння процессів, що відбуваються при работі
Cd-Ni гальванічного елемента та визначити його напругу:
Cd|CdS 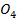 ||NiS
||NiS 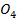 |Ni
|Ni
Розв’язок:
1.З таблиці стандартних електродних потенціалів ( табл. 9.1) знаходимо стандартні потенціали Cd та Ni
(А-) Cd|CdS 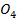 ||NiS
||NiS 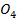 |Ni (К+)
|Ni (К+)
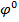 Cd/
Cd/ 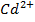 = -0,40 В
= -0,40 В 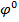 Ni/
Ni/ 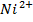 = -0,25 В
= -0,25 В
та визначаємо анод – систему з найменшим потенціалом (Cd) та систему з найбільшим потенціалом (Ni). Робимо ці позначки на схемі гальванічного елемента.
2.При роботі гальванічного елемента відбуваються наступні процеси:
Cd – анод, окислюється – з основного стану перейде у розчин у вигляді йону 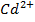 ; на катоді – йон із розчину
; на катоді – йон із розчину 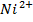 відновится та перейде на металевий катод -
відновится та перейде на металевий катод - 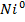 .
.

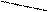 (А-) Cd|CdS
(А-) Cd|CdS 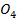 ||NiS
||NiS 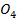 |Ni (К+)
|Ni (К+)
А -) Cd - 2 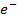 →
→ 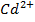 │ 1 - процес окиснення
│ 1 - процес окиснення
К+) 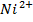 +2
+2 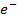 →
→ 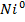 │ 1 - процес відновлення
│ 1 - процес відновлення
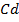 +
+ 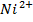 →
→ 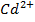 +
+ 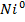 – сумарне йонне рівняння
– сумарне йонне рівняння
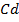 + NiS
+ NiS 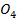 → CdS
→ CdS 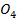 +
+ 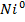 – молекулярне рівняння
– молекулярне рівняння
Напруга 𝜺(EPC) завжди позитивна та визначається за формулою
𝜺(EPC) = 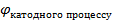 -
- 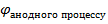
𝜺 = -0,25 – (-0,40) = 0,15 В.
Відповідь: Cd – анод окислюється, йони 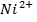 - відновлюються. Напруга Cd-Ni гальванічного елемента становить 0,15 В.
- відновлюються. Напруга Cd-Ni гальванічного елемента становить 0,15 В.
Приклад 4. Розрахувати електродний потенціал заліза в розчині його солі при концентрації 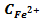 =0,03 моль/
=0,03 моль/ 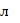 .
.
Розв’язок: Електродний потенціал елемента в розчині його солі при стандартних умовах можна визначити за рівнянням Нернста
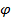 =
= 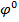 +
+ 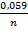 lgC
lgC
Знаходимо стандартний електродний потенціал ( 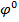 ) з табл. 9.1
) з табл. 9.1
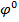 Fe/
Fe/ 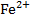 = -0,44 В
= -0,44 В
Визначаємо lgC за допомогою таблиці лагорифмів (стор. 232) С = 0.03 моль/ 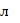 .
.
Lg0,03 = lg 3 · 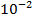 = lg3 + lg
= lg3 + lg 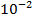 = 0,48 + (-2) = -1,52
= 0,48 + (-2) = -1,52
Розраховуємо електродний потенціал заліза при нестандартних умовах за рівнянням Нернста 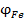 = -0,44 +
= -0,44 + 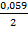 (-1,52) = -0,44 + (-0,045) = -0,485 В.
(-1,52) = -0,44 + (-0,045) = -0,485 В.
Відповідь: електродний потенціал заліза при нестандартних умовах становить 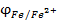 = -0,485 В.
= -0,485 В.
Завдання для самостійної роботи
Завдання 1.Розрахувати електродний потенціал ……… в розчині його солі при концентрації […….] моль/л.
Завдання 2. Визначити, який із металів можна використовувати як анод (катод),якщо катодом (анодом) буде ……….
Завдання 3. Записати схему …….. гальванічного елемента, вказати анод та катод. Визначити процеси, які відбуваються на електродах. Обчислити 𝜺 (EPC) при стандартних умовах.
| Вариант | Завдання1 | Завдання 2 | Завдання3 |
| Mg2+ , См= 0,01 моль/л | як катод, якщо анод Cd | Au-Ni | |
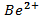 , См= 0,01 моль/л , См= 0,01 моль/л | як анод, якщо катод Al | Sn-Ni | |
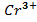 , 0,001 M, , 0,001 M, | як анод, якщо катод Sn | Sn-Cr | |
. 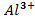 , 0,001 M, , 0,001 M, | як катод, якщо анод Mn | Sn-Pt | |
. 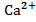 , 0,01 М , 0,01 М | як анод, якщо катод Cd | Fe-Pt | |
. 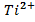 , 0,01 M, , 0,01 M, | як катод, якщо анод є Cr | Al-Pb | |
| Cu, 0,01 M, | як анод, якщо катод є Zn | Ti-Pb | |
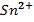 , 0,1 М, , 0,1 М, | як анод, якщо катод є Zn | Au-Zn | |
| Mn, 0,001M, | як анод, якщо катод є V. | Ti-Cr | |
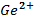 , 0,01M, , 0,01M, | як анод, якщо катод є Co | Ag-Cr | |
. 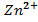 , 0,1 М , 0,1 М | як катод, якщо анод є Zn | Hg-Ni | |
| Fe, 0,001 M | як анод, якщо катод є Ti | Mn-Ni | |
. 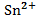 , 0,02 М , 0,02 М | як катод, якщо анод є Cu | Ag-Cu | |
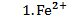 , 0,05 М , 0,05 М | як катод, якщо анод є Ag | Hg-Ni | |
. 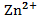 , 0,04 М , 0,04 М | як анод, якщо катод є Ni | Mn-Ni | |
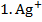 , 0,002 М , 0,002 М | як анод, якщо катод є Cu | Zn-Cd | |
. 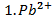 ,0,05M ,0,05M | як анод, якщо катод Co | Mg-Ti | |
. 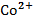 , 0,2 М , 0,2 М | катод, якщо анодом є Cr | Sn-Cd |
