Составление уравнений окислительно-восстановительных реакций. Существует два способа расстановки стехиометрических коэффициентов окислительно-восстановительных реакций: метод электронного баланса и метод
Существует два способа расстановки стехиометрических коэффициентов окислительно-восстановительных реакций: метод электронного баланса и метод электронно-ионных полуреакций.
Подбор стехиометрических коэффициентов
методом электронного баланса
Последовательность составления уравнений окислительно-восстановительных реакций:
1.Определить вещество, выполняющее функции среды (кислота, щелочь или вода).
2.Определить элементы, изменяющие степень окисления.
Как правило, не изменяют степени окисления:
а) ионы Ме 1-3 групп главных подгрупп (Na+, K+);
б)Н+ (кроме реакций взаимодействия металлов с кислотами);
в) О-2 (кроме Н2О2 и реакций термического разложения некоторых солей).
3.Записать электронные схемы:
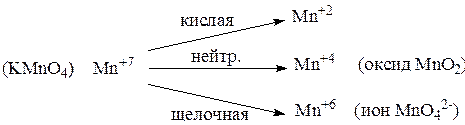 |
а)
 б) Cr+6
б) Cr+6  Cr+3
Cr+3
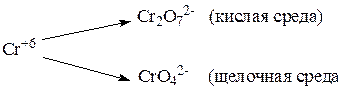 Ион хрома со степенью окисления 6+ существуют в виде хромата- и дихромата- иона. Это равновесие зависит от среды:
Ион хрома со степенью окисления 6+ существуют в виде хромата- и дихромата- иона. Это равновесие зависит от среды:
 в) Fe2+
в) Fe2+  Fe3+
Fe3+
г) для галогенов наиболее характерна степень окисления –1;
д) из отрицательных степеней окисления процесс окисления, как правило, идет до степени окисления = 0;
е) во всех остальных случаях целесообразно изменять степень окисления на 2 единицы.
4.Баланс электронов. Количество отданных электронов должно быть равно числу принятых электронов.
5.Записать продукты реакции.
Для того чтобы правильно закончить уравнение реакции, надо написать продукт взаимодействия оксида элемента (если степень окисления > 0) или водородного соединения элемента (если степень окисления < 0) со средой. Для этого необходимо знать свойства оксидов (основные, кислотные, амфотерные, несолеобразующие).
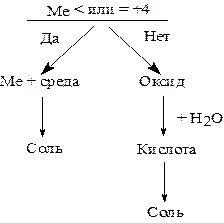
а) элементы, приобретающие в ОВР степень окисления = 0, выделяются в свободном виде;
б) наиболее часто встречающиеся несолеобразующие оксиды: СО, N2O, NO;
в) не изменяющиеся ионы левой части в правой части уравнения ОВР соединяют с ионами среды;
г) отсутствующий водород записывают в виде Н2О.
6.В соответствии с балансом электронов уравнять элементы, изменяющие степень окисления.
7.Уравнять ионы, не входящие в состав среды.
8.Уравнять ионы, входящие в состав среды.
9.Уравнять Н.
10.Проверить кислород.
Пример 20. Составить уравнение реакции восстановления оксида Fe(III) углем, если реакция протекает по схеме: Fe2O3+ C → Fe + CO↑
Дано: схема реакции Fe2O3+ C → Fe + CO↑
Составить: уравнение заданной реакции.
Решение:
Железо восстанавливается, понижая степень окисления с+3 до 0;
Углерод окисляется, его степень окисления повышается от 0 до +2.
Составим схемы этих процессов, указывая степень окисления элементов:
 Fe+3 + 3ē → Fe0 2 процесс восстановления, окислитель Fe+3
Fe+3 + 3ē → Fe0 2 процесс восстановления, окислитель Fe+3
С0 - 2ē → С+2 3 процесс окисления, восстановитель С0
Fe2O3+ 3C → 2Fe + 3CO↑
Пример 21. На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
K2Cr2O7 + HCl → КСl + CrCI3 + H2O + Cl2
Дано: схема реакции K2Cr2O7 + HCl → КСl + CrCI3 + H2O + Cl2
Составить: уравнение заданной реакции
Решение:
+6 +1 -1 +3 0
K2Cr2O7 + HCl → КСl + CrCI3 + H2O + Cl2
Степень окисления атома хрома в К2Cr2O7 равна +6 в CrСl3 равна +3, степень окисления атома хлора в НСl равна -1 в Cl2 равна 0.
 Cr+6 + 3e ® Cr+3 3 процесс восстановления, окислитель Cr+6
Cr+6 + 3e ® Cr+3 3 процесс восстановления, окислитель Cr+6
Cl-1 – 1e ® Cl0 1 процесс окисления, восстановитель Cl-
Так как в молекуле дихромата калия два атома хрома, то в электронном уравнении следует взять также два атома хрома (+ 6). Общее кратное для числа электронов равно 6, поэтому для первого уравнения получаем коэффициент 1, а для второго – 6. Переносим полученные коэффициенты в уравнение реакции, находим коэффициенты для других веществ подбором их в соответствии с законом сохранения массы, получаем уравнение:
К2Сr2О7 + 14HCl = 2CrCl3 + 2KCl + 3Cl2 + 7H2O
Подбор стехиометрических коэффициентов
методом электронно-ионных полуреакций
Применяется для ионных окислительно-восстановительных процессов и основан на составлении частных уравнений реакций восстановления ионов (молекул) окислителя и окисления ионов (молекул) восстановителя. Для этого необходимо составить ионную схему реакции. Не изменяющиеся ионы в ионную схему не включаются.
КMnO4 + FeSO4 + H2SO4 ® MnSO4 + Fe2(SO4)3 + K2SO4 + H2O
MnO4- + Fe2+ + H+ ® Mn2+ + Fe3+ + H2O
Ионы Fe2+ окисляются в ионы Fe3+, а ионы MnO4- восстанавливаются до ионов Mn2+. При выводе общего уравнения для баланса атомов необходимо добавить ионы водорода, чтобы связать атомы кислорода в воду:
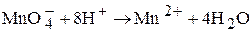
для баланса зарядов в левой части уравнения нужно добавить 5 электронов
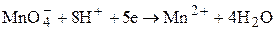
При выводе общего уравнения реакции частные уравнения надо умножить на такие коэффициенты, чтобы число отданных электронов равнялось числу принятых электронов.
 Fe2+ - ē ® Fe3+ 5
Fe2+ - ē ® Fe3+ 5
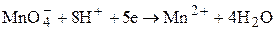 1
1
Переносим полученные коэффициенты в уравнение реакции, находим коэффициенты для других веществ подбором их в соответствии с законом сохранения массы, получаем уравнение:
2 КMnO4 + 10 FeSO4 + 8 H2SO4 ® 2 MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8 H2O
Изучение окислительно-восстановительных реакций имеет важное значение для понимания механизма возникновения и протекания реакции горения – сложного физико-химического процесса, в основе которого лежат экзотермические окислительно-восстановительные реакции.
Необходимым условием возникновения горения является одновременное наличие трех факторов: окислителя, восстановителя и источника зажигания. Окислителем, как правило, является кислород воздуха, а восстановителем – горючее вещество. Однако горение может происходить и в среде других газообразных окислителей, таких, как фтор, хлор, пары серы. При наличии веществ, выделяющих кислород, горение может происходить в инертной среде (например, горение черного пороха за счет кислорода, выделяющегося при разложении KNO3).
Наличие окислительной среды является необязательным условием и в том случае, когда окислитель и восстановитель находятся в одной молекуле (реакция внутримолекулярного окисления-восстановления, реакции диспропорционирования). К таким примерам относятся взрывы ацетилена, пероксида водорода, перхлората калия. В ряде случаев горение может возникнуть без источника зажигания, например, при тепловом и химическом самовозгорании вещества. Тепловое самовозгорание происходит при достаточно низких температурах (0...100 °С) в результате саморазогревания веществ за счет протекающих в нем изотермических окислительно-восстановительных реакций. Примерами являются самовозгорание рубидия, цезия навоздухе, самовозгорание алюминия в раздробленном состоянии. Химическое самовозгорание возникает в месте контакта реагирующих веществ с сильными окислителями, например, самовозгорание щелочных металлов с галогенами, самовозгорание ацетона, некоторых эфиров, глицерина с пероксидом натрия.
При оценке пожарной опасности технологических процессов, хранения и транспортировки веществ нужно располагать сведениями об их окислителъно-восстановительных свойствах. Вещества, проявляющие восстановительные свойства, как правило, являются горючими. Горючие газы, пары горючих жидкостей, пыли твердых горючих веществ образуют с воздухом взрывоопасные смеси. Вещества с сильно выраженными окислительными свойствами не горят, но при контакте с горючими веществами могут вызывать их химическое самовозгорание. Ряд окислителей, таких, как пероксиды, кислородные соединения галогенов, являются взрывоопасными. По каким же признакам можно установить, какие свойства проявляет вещество: окислительные или восстановительные?
Для простых веществ таким признаком является строение атома и химические свойства, которые зависят от положения элемента в периодической системе. Атомы элементов, которые находятся в начале периода, имеют малое значение потенциала ионизации и сродства к электрону, они легко отдают электроны при химических реакциях. Поэтому простые вещества, образованные этими элементами, входящими в состав IАи IIАгруппы, являются сильными восстановителями (Н2, Li, Na, K, Mg, Ca и т.д.).
В периодах слева направо величина потенциала ионизации и сродства к электрону увеличивается, поэтому в периодах слева направо усиливаются окислительные свойства иослабевают восстановительные свойства. В конце периода в VIAгруппе и в VIIАгруппе находятся сильные окислители (О2, F2, Сl2, Вг2, I2). В группах в главных подгруппах сверху вниз усиливаются восстановительные свойства, например, в IА группе у Rb и Cs восстановительные свойства выражены сильнее, чем у Li и Na. Окислительные свойства в группах сверху вниз ослабевает, поэтому вVIIАгруппе F2является более сильным окислителем, чем у С12, Вr2, I2. Элементы побочных подгрупп, относящиеся к d-семейству, являются металлами, у которых преобладают восстановительные свойства.
Пример 22.Какую высшую и низшую степень окисления проявляют мышьяк, селен и бром? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
Дано:
Химические элементы: As, Se, Br
Найти: ВСО, НСО химических элементов -?
Решение:Высшую степень окисления элемента определяет номер группы периодической системы Д. И. Менделеева, в которой он находится. Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того количества электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки (ns2np6). Данные элементы находятся соответственно в главных подгруппах V, VI, VII-групп и имеют структуру внешнего энергетического уровня s2р3, s2p4, s2p5. Следовательно, степени окисления мышьяка, селена, брома в соединениях таковы:
Так как ВСО = № группы, НСО = № группы – 8, то для:
ВСО(Аs) = +5, НСО(As) = -3 (As2O5, AsH3);
ВСО(Se) = +6, НСО(Se) = -2 (SeO3, Na2Se);
ВСО(Br) = +7, НСО(Br) = -1 (КВrO4, KBr).
Ответ: ВСО(Аs) = +5, НСО(As) = -3 (As2O5, AsH3); ВСО(Se) = +6, НСО(Se) = -2 (SeO3, Na2Se); ВСО(Br) = +7, НСО(Br) = -1 (КВrO4, KBr).
Пример 23.У какого из элементов четвертого периода марганца или брома сильнее выражены металлические свойства?
Дано:
Химические элементы: Mn, Br
Сравнить: химические свойства предложенных элементов исходя из ПСЭ.
Решение:Электронные формулы данных элементов:
25Mn 1s22s22p63s23p64s23d5
35Br 1s22s22p63s23p64s23d104p5
Марганец – d-элемент VII-группы побочной подгруппы, а бром – p-элемент VII-группы главной подгруппы. На внешнем энергетическом уровне у атома марганца два электрона, а у атома брома – семь.
Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, а, следовательно, тенденцией терять эти электроны (проявляют донорные свойства). Они обладают только восстановительными свойствами и не образуют отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трех электронов, обладают определенным сродством к электрону, а, следовательно, приобретают отрицательную степень окисления и образуют отрицательные ионы (проявляют акцепторные свойства). Таким образом, марганец, как и все металлы, обладает только восстановительными свойствами, тогда как для брома, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Следовательно, металлические свойства более выражены у марганца.
Ответ: Металлические свойства более выражены у марганца.
Комплексная задача №3
При проектировании цеха по производству химического вещества (Х) в промышленных масштабах необходимо указать расположение вентиляционных шахт для вывода людей из рабочей зоны, в которой возможно возникновение чрезвычайной ситуации.
Задания (вещество Х определяется вариантом):
1. Рассчитать молярную массу газообразного вещества (Х) по указанной относительной плотности газа;
2. Используя состав вещества (Х) в массовых процентах, определить формулу вещества (Х);
3. Определите порядковые номера, число нейтронов, число протонов, число электронов, номер периода и номер группы периодической системы химических элементов, в которых находятся атомы элементов, входящих в состав молекулы.
4. Напишите электронную формулу атомов химических элементов, входящих в состав молекулы. Определите электронные семейства, к которым относятся элементы.
5. Определите квантовые числа валентных электронов в наиболее электроотрицательном атоме, входящем в состав молекулы.
6. Используя метод валентных связей, показать образование молекулы (Х);
7. Определите степени окисления атомов в молекуле.
6.Сравните окислительно-восстановительные, кислотно-основные свойства атомов химических элементов, входящих в состав молекулы, проанализировав их положение в периодической таблице Д.И. Менделеева.
8. Определите тип химической связи в молекуле (Х) на основании разности электроотрицательностей атомов (электроотрицательности приведены в Приложении 2 табл. 1).
9. Оценить пожарную опасность (горючее вещество или окислитель) химического вещества (Х), используя справочник [4].
Таблица 7
Варианты заданий
| Nп/п | Относительная плотность газа (Х) | Состав вещества в масс.% | Nп/п | Относительная плотность газа (Х) | Состав вещества в масс.% |
| 1. | 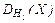 = 32,00 = 32,00 | О – 50,00 S – 50,00 | 21. | 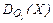 = 2,11 = 2,11 | Cl – 52,56 O – 47,44 |
| 2. | 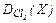 = 1,127 = 1,127 | О – 60,00 S – 40,00 | 22. | 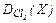 = 1,23 = 1,23 | Cl – 81,59 O – 18,41 |
| 3. | 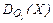 = 0,875 = 0,875 | C – 42,86 O – 57,14 | 23. | 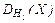 = 22,01 = 22,01 | N – 63,65 O – 36,35 |
| 4. | 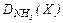 = 2,588 = 2,588 | C – 27,273 O – 72,727 | 24. | 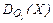 = 0,53 = 0,53 | N – 82,26 H – 17,74 |
| 5. | 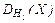 = 18,25 = 18,25 | Cl – 97,26 H – 2,74 | 25. | 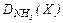 = 1,76 = 1,76 | N – 46,68 O – 53,32 |
| 6. | 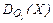 = 0,625 = 0,625 | F – 95,00 H –5,00 | 26. | 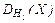 = 23,01 = 23,01 | N – 30,45 O – 69,55 |
| 7. | 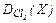 = 1,803 = 1,803 | I – 99,22 H – 0,78 | 27. | DCO(X) = 1,15 | Si – 87,45 H – 12,55 |
| 8. | 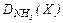 = 4,765 = 4,765 | Br – 98,765 H – 1,235 | 28. | 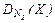 = 1,68 = 1,68 | Be – 19,17 F – 80,83 |
| 9. | 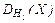 = 8,00 = 8,00 | C – 75,00 H – 25,00 | 29. | 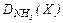 = 1,99 = 1,99 | H – 8,89 P – 91,11 |
| 10. | 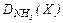 = 5,176 = 5,176 | C – 13,64 F – 86,36 | 30. | 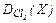 = 1,09 = 1,09 | As – 96,12 H – 3,88 |
| 11. | 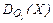 = 2,38 = 2,38 | C – 15,77 S – 84,23 | 31. | 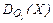 = 3,89 = 3,89 | H – 2,42 Sb – 97,58 |
| 12. | 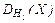 = 43,97 = 43,97 | P – 35,22 F – 64,78 | 32. | 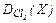 = 1,52 = 1,52 | F – 70,33 S – 29,67 |
Окончание таблицы 7
