Аморфные и кристаллические тела
АТОМНО-КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ МАТЕРИАЛОВ
Жидкости и твердые тела в отличие от газов находятся в конденсированном состоянии.При этом атомы располагаются ближе друг к другу, чем в газах, что приводит к более сильному их взаимодействию. В результате жидкости и твердые тела имеют постоянный собственный объем (при постоянных температуре и давлении), а твердые тела - и постоянную форму.
Атомы в твердых телах удерживаются силами химических связей. К основным типам связей относятся: ковалентная (гомеополярная), ионная (гетерополярная) и металлическая. Они возникают в результате обмена или объединения валентных электронов.
Типы химических связей
Наиболее прочной является металлическая связь. Ее энергия может составлять 104 Дж/моль. Слабосвязанные валентные электроны в металлах легко покидают свои атомы и свободно перемещаются в пределах кристалла. Таким образом происходит объединение валентных электронов всех атомов в кристалле.
Металлы можно рассматривать как системы, построенные из расположенных в узлах решетки положительных ионов, образующих «остов» кристалла, и отрицательно заряженного электронного газа, состоящего из коллективизированных валентных электронов. Ионы и электроны связаны электростатическими силами. Существование электронного газа определяет высокую электро- и теплопроводность, пластичность, прочность и другие характерные свойства металлических материалов.
Ковалентная связь образуется в результате обобществления валентных электронов соседних атомов. При этом их электронные облака образуют единое облако, принадлежащее одновременно обоим атомам, и каждый из атомов имеет стабильную двух- или восьмиэлектронную конфигурацию внешней электроннойоболочки. Ковалентная связь является направленной (образуется в направлении наибольшей плотности электронного облака). Вещества с типично ковалентной связью: Н2, 02, алмаз Si, Ge и др. Энергия связи весьма значительна -105 Дж/моль. Высоки также температура плавления, прочность и твердость.
Ионная связь является результатом электростатического притяжения разноименно заряженных ионов и образуется между атомами элементов с различной электроотрицательностью. При достаточном сближении их электронные оболочки соприкасаются, но взаимного проникновения этих оболочек не происходит. Типично ионная связь образуется между элементами I и VII групп (NaCl, CsF и т. д.). В этом случае атом металла отдает валентный электрон и становится положительно заряженным ионом, а атом неметалла его принимает и становится отрицательно заряженным ионом; при этом их внешние электронные оболочки приобретают стабильную восьмиэлектронную конфигурацию. Энергия ионной связи сопоставима с ковалентной. Ионные соединения отличаются, как правило, высокой температурой плавления, твердостью, прочностью и низким температурным коэффициентом линейного расширения. Все электроны в ионных кристаллах локализованы на орбиталях отдельных атомов и не могут принимать участие в электропроводности, поэтому ионные кристаллы являются изоляторами.
Связь Ван-дер-Ваальса — наиболее слабая химическая связь, которая сводится к электростатическому взаимодействию между атомами, ионами и молекулами в веществе. Ее энергия на два порядка ниже энергии ионной и ковалентной связей. Она обусловлена взаимным влиянием полей электронов, движущихся вокруг ядер соседних атомов. При образовании связи Ван-дер-Ваальса не происходит ни обобществления, ни обмена электронами, имеет место лишь действие сил притяжения между молекулами или атомами, являющимися малыми диполями. Образование диполей в атоме или молекуле происходит из-за того, что центр отрицательных зарядов (электронов) может не совпадать с ядром, имеющим положительный заряд. Силы Ван-дер-Ваальса быстро убывают с увеличением расстояния между атомами.
Аморфные и кристаллические тела
В зависимости от степени упорядочения атомов твердые тела можно разделить на два класса - кристаллические и аморфные (Рис. 2.1).

Рис. 2.1. Кристаллические (а) и аморфные (б) тела
Для аморфных твердых тел (рис. 2.1, б) характерны изотропность свойств и отсутствие определенной температуры плавления. Изотропность свойств аморфных тел проявляется в том, что характеристики их тепло- и электропроводности, прочности, теплового расширения, скорости роста, травления и т. д. не зависят от направления, в котором они измеряются. При повышении температуры аморфные твердые тела размягчаются и постепенно в некотором интервале температур переходят в жидкое состояние. В аморфных твердых телах отсутствует дальний порядок — строгая периодическая повторяемость атомов в пространстве, — однако им присущ так называемый ближний порядок, соблюдаемый в пределах первой координационной сферы (составленной всеми соседними атомами, ближайшими к данному), т. е. соблюдающийся лишь на расстояниях 0,5—1,0 нм.
Подавляющее большинство твердых тел имеет кристаллическое строение (рис. 2.1, а). Кристаллическим твердым телам присущ дальний порядок, когда правильное упорядоченное расположение атомов в пространстве распространяется не только на ближайших соседей, но и на соседей, находящихся на более далеком расстоянии. При этом атомы образуют пространственную кристаллическую решетку. В идеальной кристаллической решетке атомы расположены в строго определенном геометрическом порядке. Кристаллическое состояние твердого тела более стабильно, чем аморфное. Например, при нагреве, длительной выдержке при комнатной температуре, иногда при деформации твердые тела переходят частично или полностью из аморфного состояния в кристаллическое. В отличие от аморфных кристаллические твердые тела сохраняют свою форму при нагреве. Их плавление и переход в жидкое состояние происходит при определенной температуре (температуре плавления).
Для описания кристаллического строения твердых тел пользуются понятием кристаллической решетки. Она представляет собой пространственную сетку, в узлах которой располагаются атомы, ионы или молекулы, образующие твердое тело. В идеальной кристаллической решетке атомы расположены в строго определенном геометрическом порядке. Идеальную кристаллическую решетку можно построить путем многократного повторения с последовательной трансляцией (переносом в пространстве) в трех направлениях так называемых элементарных ячеек, которые являются первичными звеньями кристаллической решетки.
Элементарная ячейка — это наименьший объем кристалла, который еще передает характерные особенности кристаллической решетки. Элементарная ячейка представляет собой элементарный параллелепипед, стороны которого принимают за оси координат кристалла (х, у, z), а наименьшие расстояния между узлами вдоль осей х, у и z обозначают соответственно а, b, с и называются параметрами, или периодами решетки. Геометрически возможно существование 14 типов кристаллических решеток.
По расположению атомов в элементарной ячейке кристаллические решетки подразделяются на простые и сложные.
В простых (примитивных) решетках атомы располагаются только по вершинам ячейки, т.е. на долю каждой из них приходится один атом.
Сложными называются решетки, в которых на долю каждой ячейки приходится более одного атома. К часто встречающимся сложным решеткам относятся следующие тетрагональные решетки:
— объемно-центрированные, в которых атомы располагаются в вершинах и в центре параллелепипеда;
— гранецентрированные — решетки с атомами, расположенными в вершинах и в центрах всех граней параллелепипеда;
— базоцентрированные, имеющие атомы в вершинах и, в центрах противоположных граней параллелепипеда.
Существуют также решетки с гексагональной симметрией. Среди промышленных металлов наиболее распространенными являются следующие типы кристаллических решеток (рис. 2.2):
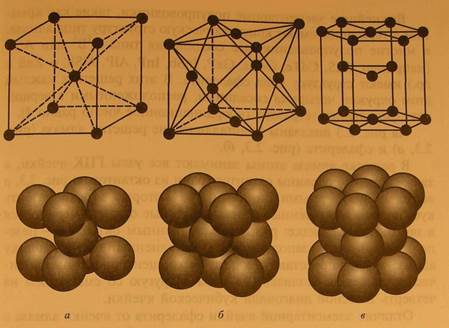
Рис. 2.2. Типы наиболее распространенных кристаллических решеток и схемы
упаковки атомов:
а — объемно-центрированная кубическая; б — гранецентрированная кубическая; в — гексагональная плотноупакованная
— кубическая объемно-центрированная (ОЦК решетка, рис. 2.2, а) (координационное число — количество ближайших к данному атому соседних атомов — равно 8): Na, V, Nb, Сг, Та, Mo, W, Li, b-Ti, Ba, Cs, Rb и др.;
— кубическая гранецентрированная (ГЦК решетка, рис. 2.2, б) (координационное число равно 12): Сu, Al, Pt, Pb, Ag, Au, Ni и др.;
— гексагональная плотноупакованная (ГПУ решетка, рис. 2.2, в) (координационное число равно 12): Mg, Zn, Hf, Re, a-Ti, Be, Co, Zr, Cd и др.
ГЦК и ГПУ решетки являются плотноупакованными, они имеют наивысший коэффициент компактности (отношение объема, занимаемого атомами в элементарной ячейке, к ее полному объему), равный 0,74. Для сравнения, у ОЦК решетки коэффициент компактности равен 0,68, у решетки типа алмаза - 0,34.
Металлы, обладающие полиморфизмом, кристаллизируются в нескольких решетках, например Fea-ОЦК, Feg-ГЦК.

 Важнейшие элементарные полупроводники, такие как кремний и германий, имеют кристаллическую структуру типа алмаза, а многие полупроводниковые соединения типа А2Вб или А3В5 (например, CdS, CdTe, GaAs, GaP, InSb, InP, A1P, AlSb, a-ZnS и др.) имеют структуру типа сфалерита. В этих решетках каждый атом окружен четырьмя соседними, расположенными в вершинах правильного тетраэдра (координационное число равно 4).
Важнейшие элементарные полупроводники, такие как кремний и германий, имеют кристаллическую структуру типа алмаза, а многие полупроводниковые соединения типа А2Вб или А3В5 (например, CdS, CdTe, GaAs, GaP, InSb, InP, A1P, AlSb, a-ZnS и др.) имеют структуру типа сфалерита. В этих решетках каждый атом окружен четырьмя соседними, расположенными в вершинах правильного тетраэдра (координационное число равно 4).
На рис. 2.3 показаны кристаллические решетки алмаза (рис. 2.3, а) и сфалерита (рис. 2.3, б).
В решетке алмаза атомы занимают все узлы ГЦК-ячейки а также центры половины октантов (один из октантов на рис. 2.3, а выделен пунктирными линиями), на которые можно разбить куб, причем заполненные и незаполненные октанты чередуются в шахматном порядке: рядом с заполненным октантом — незаполненный, под незаполненным — заполненный и т. д. Решетку алмаза можно представить как две гранецентрированные кубические решетки, вставленные одна в другую со смещением на четверть телесной диагонали кубической ячейки.
Отличие элементарной ячейки сфалерита от ячейки алмаза в том, что в алмазе все атомы одинаковы, а в сфалерите атомы одного сорта (например, галлия) занимают узлы ГЦК-ячейки, а атомы другого сорта (например, фосфора) — центры четырех октантов.
Весьма распространены в природе также химические соединения со структурой каменной соли NaCl (рис. 2.4). Структуру типа NaCl можно описать как две ГЦК решетки, вставленные в друг друга так, что вершины ячеек структуры А расположены в центрах ребер ячеек структуры В. Структуру типа NaCl имеют все галогениды щелочных металлов (за исключением CsCl, CsBr и Csl), многие сульфиды, селениды и теллуриды магния, кальция, стронция, бария, свинца, марганца, оксиды переходных элементов TiO, MnO,
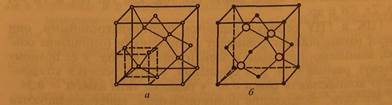
Рис. 2.3. Кристаллические решетки алмаза (а) и сфалерита (б)
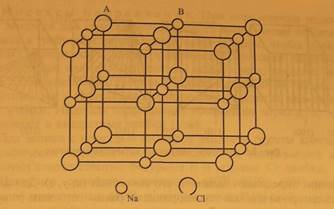
Рис. 2.4. Структура каменной соли
FeO, MgO, карбиды и нитриды некоторых переходных металлов, например TiC, TiN, TaC, ZrC, ZrN, UN, UC, галоиды серебра AgCl, AgBr, AgF.
Для некоторых кристаллических веществ характерно явление изоморфизма: это означает, что разные, но близкие по химической природе вещества, имеющие близкие значения атомных радиусов, т.е. расположенные недалеко друг от друга. В периодической таблице, имеют одинаковый тип кристаллической решетки. Например, Ag и Au; Ge и Si. Химические соединения также могут быть изоморфны, например Сг2Оз и Аl2Оз.
Одно и то же вещество при разных температурах может иметь разные кристаллические решетки. Такое явление называется полиморфизмом и характерно как для элементарных веществ, таких как Fe, Ti, Sn и других, так и для химических соединений, например для А1203.
 Анизотропия свойств кристаллов.
Анизотропия свойств кристаллов.
Разные кристаллографические направления и плоскости направления [100] и [111], плоскости (100) и (110) в ОЦК решетке. Вследствие этого одно и то же векторное свойство, измеренное в разных на 

 правлениях, имеет разные значения. Векторными свойствами являются электро- и теплопроводность, оптические, механические и магнитные свойства, скорость роста и травления и т. д. Анизотропия механических свойств, например, проявляется в способности кристаллов слюды раскалываться на тонкие пластинки, что обусловлено разным значением прочности в двух перпендикулярных направлениях. Анизотропия скорости роста кристалла из расплава или раствора определяет его правильную форму.
правлениях, имеет разные значения. Векторными свойствами являются электро- и теплопроводность, оптические, механические и магнитные свойства, скорость роста и травления и т. д. Анизотропия механических свойств, например, проявляется в способности кристаллов слюды раскалываться на тонкие пластинки, что обусловлено разным значением прочности в двух перпендикулярных направлениях. Анизотропия скорости роста кристалла из расплава или раствора определяет его правильную форму.
Скалярные свойства (температура плавления, теплоемкость, плотность и т. д.) не зависят от направления их измерения в кристалле.
Анизотропия кристаллов учитывается при производстве и обработке различных монокристаллов (полупроводников, кварца и т. д.), которые выращивают и вырезают в определенных кристаллографических направлениях для получения нужных свойств.
