Реакции электрофильного замещения в ароматическом ядре
л-Электронное облако ароматического кольца является объектом атаки электрофильными реагентами.
Арены вступают в ионные реакции, протекающие по механизму электрофильного замещения, обозначаемого символом SE (от англ. substitution electrophilic).
В общем виде замещение протона в бензольном кольце электрофиль- ной частицей Е+ можно представить следующим образом:
Реакция протекает через несколько стадий. Прежде всего необходимо создать электрофильную частицу из нейтральной молекулы реагента E-Y. Это достигается применением катализатора, способного либо сильно поляризовать связь E-Y, либо полностью ее разорвать гетеролитически.
Электрофильная частица образует с субстратом нестойкий п-комплекс, в котором она одновременно связана со всеми пи-электронами ароматической системы.
На решающей (медленной) стадии электрофильная частица образует ковалентную связь с одним из атомов углерода за счет двух электронов пи-системы кольца. При этом атом углерода переходит из sp2- в sp3-гибридное состояние и ароматическая система нарушается. Четыре оставшиеся пи-электрона распределяются между пятью атомами углерода цикла, и молекула бензола превращается в сигма-комплекс (карбокатион).
На завершающей (быстрой) стадии происходит стабилизация о-комплекса. Для него более выгодна стабилизация не за счет присоединения нуклеофильной частицы, как это имело место в реакции присоединения в алкенах, а путем отщепления протона от атома углерода, связанного с электрофилом. При этом с участием двух электронов разрывающейся связи С-Н воссоздается замкнутая ароматическая пи-система. 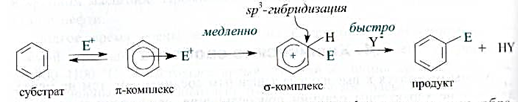
Ниже на примере бензола показаны наиболее важные реакции электро- фильного замещения.
Галогенирование.Бензол не взаимодействует с хлором или бромом при обычных условиях. Реакция протекает только в присутствии катализаторов, которыми чаще всего являются безводные галогениды алюминия или железа(Ш). В результате образуются галогенозамещенные арены.
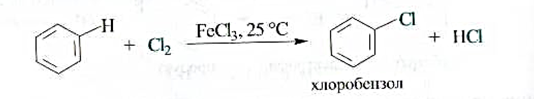
Роль катализатора заключается в поляризации нейтральной молекулы галогена с превращением ее в электрофильную частицу. При взаимодействии молекулы галогена с катализатором образуется комплекс, в котором связь между атомами галогена сильно поляризована. В результате этого может произойти диссоциация комплекса с образованием катиона галогена, например С1+, являющегося сильным электрофилом. 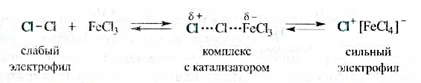
Нитрование.Бензол практически не реагирует с концентрированной азотной кислотой даже при нагревании. Однако при действии на него смеси концентрированных азотной и серной кислот, так называемой нитрующей смеси, легко происходит замещение атома водорода нитрогруппой NO2 — реакция нитрования.
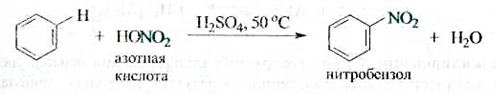
Атакующей электрофильной частицей в этой реакции является нитроил-катион NO2+, образующийся при взаимодействии азотной и серной кислот.

Сульфирование.Бензол реагирует при нагревании с концентрированной серной кислотой, а еще лучше — с олеумом (раствором триоксида серы S03 в серной кислоте). В результате атом водорода замещается суль- фогруппой S03H с образованием сульфоновой кислоты.
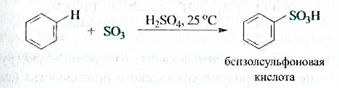
Сульфирование аренов — обратимая реакция. При нагревании с водяным паром происходит обратная реакция — десульфирование.
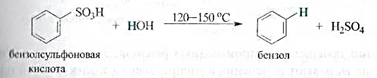
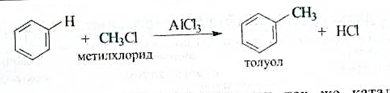
Алкилирование.Введение алкильных групп в ароматическое кольцо действием галогеноалканов известно как реакция Фриделя -Крафтса (1877). В результате образуются гомологи аренов.
Алкилирование протекает в присутствии тех же катализаторов, что и в реакции галогенирования, например галогенидов алюминия. Сходна и роль катализаторов, поляризующих молекулу галогеноалкана с образованием электрофильной частицы.