Закономерности реакций электрофильного замещения
Реакции электрофильного замещения составляют существенную часть химии ароматических соединений. Примеры таких реакций были рассмотрены раньше. Теперь наступила пора попытаться объяснить феноменологические наблюдения над реакциями, выявить общие закономерности их протекания, предложить и обосновать механизм электрофильного замещения в ароматическом ряду и на этой основе рассмотреть влияние замесителей в кольце на ориентацию и реакционную способность.
11.5.10.1. Правила замещения. Исторически сложилось так, что первоначальные обобщения над реакциями замещения были сформулированы в виде свода правил (Голлеман). Эти правила ничего не объясняли, однако позволяли бездумно предсказывать направление замещения и продукты реакции. С тех пор теоретическая органическая химия шагнула далеко вперед, однако представляется, что правила замещения не потеряли своего значения и в наши дни именно в силу своей непритязательности и предсказательных возможностей.
Обобщение большого числа реакций замещения в ароматическом ряду показало, что имеющийся в бензольном кольце заместитель влияет как на реакционную способность соединения, так и на место вступления нового заместителя в кольцо. Оказалось, что одни заместители способствуют реакции и направляют новый заместитель в о- и п-положение по отношению к имеющемуся заместителю. Они были названы заместителями 1 рода, о- и п-ориентантами и электронодонорными заместителями. Вот они:
-NH2, -NHR, -NR2, -OH, -NHCOR, -OR, -C6H5, , алкилы, галогены
Другая группа заместителей затрудняет ход реакции, а новые заместители направляют в м-положение. Эти заместители были названы заместителями 2 рода, м-ориентантами, электроноакцепторными заместителями
-CN, -CHO, --COR, -COOH, -COOR, -SO3H, -NR3 ,-CF3, -CCl3, -NO2
В ароматическом кольце может быть и несколько заместителей. Как же в таком случае формулируются правила замещения?
В дизамещенных бензолах влияние заместителей может быть согласованным или несогласованным. Следующие ароматические соединения будут вступать в реакции замещения, испытывая согласованное влияние заместителей
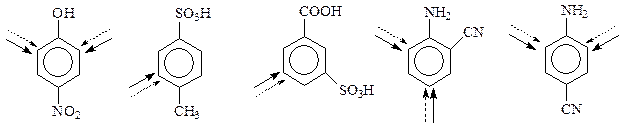
Вот примеры структур с несогласованным влиянием заместителей
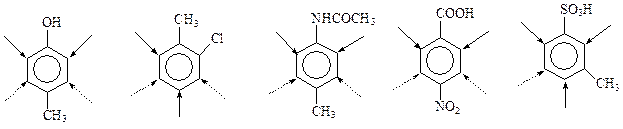
При участии в реакции таких соединений возможны следующие варианты:
1. Если кольцо содержит два электронодонорных заместителя, то реакция идет под ориентирующим влиянием более сильного из них.
2. Если в кольце находятся заместители 1 и 2 рода, то замещение протекает под ориентирующим влиянием первого из них.
3. По стерическим соображениям новый заместитель обычно не вступает в кольцо между заместителями, находящимися в м-положении.
Выше отмечалось, что в случае ди- или более замещенных бензолов реакции замещения протекают под активирующим и ориентирующим влиянием более «сильного» заместителя. Установлено, что заместители 1 рода по убыванию активирующей и ориентирующей силы располагаются в следующий ряд
-NH2> –OH> -OCH3> -NHCOCH3 > -C6H5> -CH3> м-ориентанты
В случае дизамещенных бензола, чем больше заместители различаются по силе, тем точнее соблюдаются правила замещения и тем выше их предсказательная сила. В противном случае результат реакции весьма неопределенен. Так, при нитровании п-хлортолуола, в котором метильная группа и хлор обладают близким ориентирующим эффектом, получаются оба возможных продукта с сопоставимыми выходами
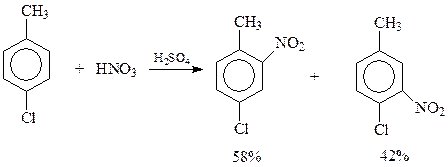
При проведении реакций замещения с участием монозамещенных бензолов возникает вопрос о соотношении продуктов замещения в о- и п-положения. У монозамещенных бензолов одно п-положение и два о-положения. Поэтому статистически соотношение продуктов должно быть 2:1 или близко к этому. В действительности бывает и наоборот. Так, при нитровании бромбензола о-изомер получается с выходом в 38%, а п-изомера образуется 62%
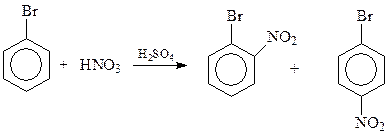
Считается, что предсказанные статистикой соотношения не соблюдаются из-за пространственных факторов. Из-за них вновь вступающие в кольцо заместители стремятся расположиться как можно дальше от имеющегося заместителя.
В связи с обсуждением закономерностей реакций замещения на эмпирическом уровне отметим еще, что иногда результаты реакции становятся неожиданными из-за трансформации заместителей. Примером может послужить сульфирование анилина. Казалось бы, это соединение, содержащее один из наиболее сильных заместителей 1 рода, должно легко сульфироваться с образованием смеси о- и п-изомеров. Однако это не так, реакция идет с трудом с образованием м-изомера. Происходит это потому, что анилин, являющийся основанием, протонируется кислотой. При этом аминогруппа, являющаяся активирующим заместителем, превращается в ион аммония, который относится к дезактивирующим заместителям. Дальше реакция идет уже под контролем иона аммония
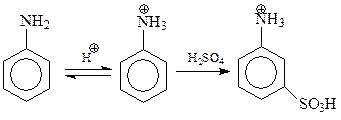
Интересно отметить, что иногда направление замещения можно изменить варьированием условий проведения реакции. Так, метилирование толуола хлористым метилом в присутствии AlCl3 при 0оC приводит к смеси о- и п-ксилолов. При проведении реакции при 80оC основным продуктом реакции становится м-ксилол
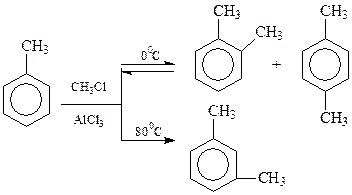
Следует отметить, что рассмотренные в данном разделе эмпирические закономерности не носят абсолютного характера. Они предсказывают лишь основное направление реакции. Так, бромирование толуола в соответствии с правилами замещения дает ожидаемую смесь о-бромтолуола (33%) и п-бромтолуола (67%). В то же время при сульфировании толуола наряду с ожидаемыми толуолсульфокислотами получается также и м-изомер (6%).
Теория резонанса
В следующем разделе будут рассматриваться современные представления о реакциях электрофильного замещения в ароматическом ряду. При этом не обойтись без теории резонанса, ставшей частью структурной теории и позволяющей в наглядной форме представить себе распределение электронной плотности в нереагирующей молекуле или в промежуточных частицах органических реакций – ионах и радикалах. Основы теории резонанса были развиты Полингом в 40-ые годы прошлого столетия.
Оперируя лишь ограниченным набором графических средств, химики творят чудеса – передают на бумаге при помощи структурных формул строение миллионов органических соединений. Однако иногда это не удается. Может быть, одним из первых примеров такого рода был бензол, свойства которого не удалось передать одной формулой. Поэтому Кекуле вынужден был для него предложить две формулы с нелокализованными двойными связями. Чтобы ясно представить себе истоки теории резонанса, рассмотрим еще несколько примеров.
Для нитрит-иона NO2- может быть предложена следующая структурная формула
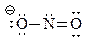
Из этой формулы следует, что в нитрит-ионе имеется два разных кислорода, один из которых несет отрицательный заряд, а другой – не заряжен. Однако известно, что в нитрит-ионе нет двух разных кислородов. Чтобы преодолеть это затруднение строение иона пришлось изобразить двумя формулами
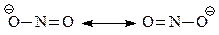
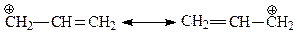
Аналогичная ситуация складывается в случае аллильного катиона, с которым мы уже встречались раньше. Для этой частицы тоже приходится использовать две формулы, которые только вместе передают все особенности строения катиона
Согласившись с необходимостью передачи строения некоторых молекул или частиц несколькими формулами, мы ставим себя перед поиском ответов на множество возникающих вопросов. Например, сколько формул передают все особенности строения частицы? Соответствуют ли подобранным формулам реальные частицы? Каково реальное распределение электронов в частице?
На эти и другие вопросы и отвечает теория резонанса на качественном уровне. Основные положения этой теории сводятся к следующему.
1. Если все тонкости строения частицы невозможно отобразить одной формулой, то это надо делать, прибегнув к нескольким структурам. Эти структуры называются резонансными, предельными, граничными, каноническими.
2. Если для частицы можно нарисовать две или больше приемлемых структур, то действительное распределение электронов не соответствует ни одной из них, а является промежуточным между ними. Реально существующая частица считается гибридом в действительности не существующих резонансных структур. Каждый из предельных структур вносит свой вклад в реальное распределение электронной плотности в частице. Этот вклад тем больше, чем ближе канонические структуры по энергии.
3. Резонансные формулы записываются с соблюдением определенных правил:
- в различных резонансных структурах положения всех атомов должны быть одинаковыми, их отличие состоит только в расположении электронов;
- граничные формулы не должны сильно отличаться по положению электронов, в противном случае вклад таких структур в резонансный гибрид будет минимальным;
- граничные структуры с существенными вкладами в резонансный гибрид должны располагать одинаковым и наименьшим числом неспаренных электронов.
4. Энергия реальной частицы меньше, чем энергия любой из предельных структур. Другими словами – резонансный гибрид стабильнее, чем любой из участвующих в резонансе структур. Такое повышение стабильности называют энергией резонанса.
Плодами качественной и наглядной теории резонанса мы воспользуемся совсем скоро - при объяснении ориентации в реакциях замещения в ароматическом ряду. Пока же отметим, что эта теория верой и правдой служит химии более 70 лет, хотя с момента публикации подвергается критике. Часто критика связана с путаными взаимоотношениями между реальной частицей и каноническими структурами. Сама теория резонанса постулирует, что канонические структуры вымышленные. Тем не менее, довольно часто им придают реальный смысл, что, конечно, не соответствует действительности. Однако при этом появляется возможность остроумно обсудить ситуацию. Так, для объяснения взаимоотношений между предельными структурами и их резонансным гибридом Т. Уэланд предложил воспользоваться биологической аналогией, которая сводится к следующему. «Когда мы говорим, что мул является гибридом осла и лошади, то при этом совсем не имеется в виду, что некоторые мулы являются ослами, а другие – лошадьми, или что каждый мул часть времени является лошадью, а другую – ослом. Мы просто имеем в виду тот факт, что мул – животное, родственное как лошади, так и ослу, и при описании его удобно сопоставить с этими знакомыми нам животными». Надо отметить, что аналогия Уэланда не вполне корректна. Ведь в отличии от предельных структур, которые в действительности не существуют, осел и лошадь – существа весьма конкретные. Кроме того, некоторые специалисты обратили внимание на субъективность отдельных постулатов теории резонанса. Продолжая обсуждение этой теории в рамках биологической аналогии Уэланда, О. А. Реутов еще в 1956 году отметил, что «концепция резонанса не может предсказать, что мул является гибридом именно лошади и осла. Это нужно знать независимым путем. В противном случае можно, например, в качестве одного из родителей взять слона и подобрать второго родителя таким образом, чтобы математически все сошлось».
В заключение отметим, что теория резонанса, несмотря на определенные недостатки, помогает химику на качественном уровне предсказать распределение электронов в молекуле или любой частице, чего, к сожалению, до сих пор не может квантовая химия.
