Примеры решения типовых задач. Задача 1.Составление формулы и диссоциация комплексного соединения, вычисление заряда комплексного иона
Задача 1.Составление формулы и диссоциация комплексного соединения, вычисление заряда комплексного иона.
Составьте формулу сульфата гексаамминкобальта (II). Напишите уравнение диссоциации этого соединения в водном растворе, определите заряд комплексного иона.
Решение:Координационное число кобальта (II), согласно названию (гексаамминкобальт), равно шести, поэтому он образует комплексный ион [Co(NH3)6]2+. Заряд иона равен +2, так как ион кобальта имеет заряд +2, а молекулы аммиака нейтральны.
Комплексное соединение имеет формулу [Co(NH3)6]SO4 и диссоциирует в водном растворе на комплексный ион и противоион внешней сферы:
[Co(NH3)6]SO4  [Co(NH3)6]2+ + SO42-.
[Co(NH3)6]2+ + SO42-.
Задача 2.Определите, чему равен заряд комплексного иона и степень окисления комплексообразователя в следующих соединениях: а) Mg[CuI4], б) [Pd(NH3)4]SO4, в) [Al(H2O)5Cl]Br2.
Решение:
а) В соединении Mg[CuI4] во внешней сфере находится двухзарядный катион Mg2+. Суммарный заряд ионов внешней сферы и комплексного иона должен быть равен нулю. Поэтому комплексный ион имеет заряд –2: [CuI4]2–. Комплексообразователем в рассматриваемом соединении является ион меди, а лигандами – иодид-ионы I– с зарядом –1. Сумма степени окисления *x комплексообразователя и суммарного заряда всех лигандов должна равняться заряду комплексного иона:
x+4·(–1)= –2 ,
откуда x=2, т.е. степень окисления комплексообразователя равна +2 (ион Cu2+).
Ответ: –2, +2.
б) Соединение [Pd(NH3)4SO4] является нейтральным комплексом (заряд внутренней сферы равен нулю, внешняя сфера отсутствует). Лигандами служат молекулы аммиака, имеющие нулевой заряд, и ион SO42–. Исходя из равенства заряда комплексной частицы сумме степени окисления комплексообразователя и зарядов всех лигандов, получаем уравнение
x+4·0+(–2)=0 ,
откуда определяем степень окисления палладия: x=2 (т.е. комплексообразователь – ион Pd2+).
Ответ: 0, +2.
в) В соединении [Al(H2O)5Cl]Br2 во внешней сфере находятся два иона Br–, суммарный заряд которых равен –2. Тогда, принимая во внимание, что молекула в целом электронейтральна, получаем, что заряд комплексного иона равен +2. Он складывается из искомой степени окисления * алюминия и зарядов лигандов – пяти нейтральных молекул воды и иона Cl– – в соответствии с уравнением
x+5·0+(–1)=2 ,
откуда x=3.
Ответ: +2, +3.
Задача 3.Напишите формулы следующих комплексных соединений: а) тетрацианодиамминплатинат (II) калия, б) динитротетраакваалюминия (III) бромид. В ответе укажите заряд комплексного иона и координационное число комплексообразователя.
Решение:
а) Согласно номенклатуре комплексных соединений, лиганды перечислены в начале названия внутренней сферы. Лигандами являются четыре иона CN– (тетрациано-) и две молекулы NH3 (диаммин-). Комплексообразователем комплексного аниона служит двухзарядный ион Pt2+ (-платинат(II)). Определим заряд z комплексного иона, складывающийся из степени окисления комплексообразователя и зарядов лигандов:
z = 2+4·(–1)+2·0 = –2
Таким образом, внутренняя сфера представляет собой анион [Pt(CN)4(NH3)2]2–. Во внешней сфере, согласно названию соединения, находятся ионы K+, количество которых равно 2, т.к. молекула должна иметь нулевой заряд. Получаем формулу комплексного соединения в виде K2[Pt(CN)4(NH3)2]. Общее количество лигандов равно 6. Оно определяет координационное число комплексообразователя.
Ответ: –2; 6.
б) Лигандами комплексного соединения являются два иона NO2– (динитро-) и четыре молекулы H2O (тетрааква-), а комплексообразователем служит Al3+ (алюминия(III)). Следовательно, заряд комплексного катиона равен
z = 3+2·(–1)+4·0 = +1 ,
а формулу комплексного иона можно записать в виде [Al(NO2)2(H2O)4]+. Судя по названию, во внешней сфере находятся бромид-ионы Br–, количество которых должно быть равно 1 согласно условию электронейтральности молекулы. Формула комплексного соединения: [Al(NO2)2(H2O)4]Br. По количеству лигандов (два иона NO2– и четыре молекулы воды) определяем, что координационное число комплексообразователя равно 6.
Ответ: +1; 6.
Задача 4.Определите, каким станет заряд комплексного иона [Cd(CNS)4]2–, если три роданидных лиганда заменить на три молекулы аммиака.
Решение:
Лиганды CNS– заряжены отрицательно, а молекулы аммиака имеют нулевой заряд. Поэтому в результате замены трех лигандов CNS– на три молекулы NH3 заряд комплексного иона увеличится на 3 и станет равным –2+3=+1 (образуется ион [Cd(NH3)3CNS]+).
Ответ: +1.
Задача 5.Составьте координационную формулу соединения NiBr2·5NH3, если координационное число комплексообразователя равно 6. В ответе укажите заряд комплексного иона.
Решение:В координационной формуле внутренняя сфера соединения (комплексообразователь и лиганды) должна быть записана внутри квадратных скобок, а внешняя сфера – за скобками. Комплексообразователем в данном случае служит ион Ni2+. Молекулы аммиака могут находиться только в числе лигандов во внутренней сфере, т.к. они электронейтральны. Бромид-ионы Br– могут быть лигандами или находиться во внешней сфере. По условию координационное число никеля равно шести, поэтому лигандами являются 5 молекул аммиака и один ион Br–, а другой бромид-ион составляет внешнюю сферу комплексного соединения [Ni(NH3)3Br]Br, в котором заряд комплексного иона равен +1.
Ответ: +1.
Задача 6. Способы разрушения комплексных соединений.
Предложите способ разрушения комплексного соединения [Co(NH3)6]SO4..
Решение:Комплекс [Co(NH3)6]2+ содержит в качестве лигандов молекулы аммиака, обладающие основными свойствами. Поэтому естественным способом разрушения этих комплексов является связывание молекул аммиака протонными кислотами. Процесс разрушения комплексов можно представить сложным равновесием, являющегося сочетанием простых равновесий (1) и (2):
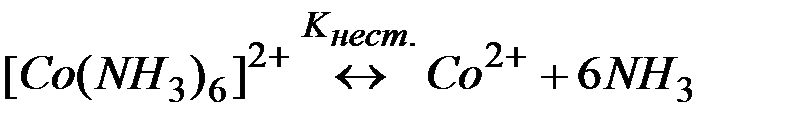 | (1) | |
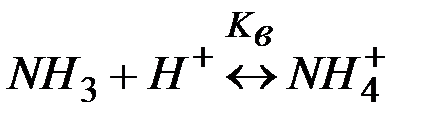 | (2) | |
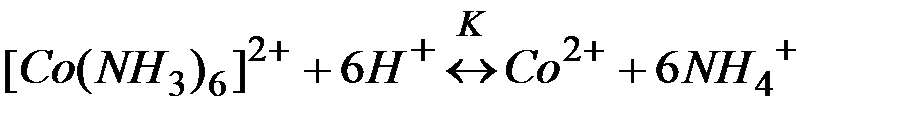 | (3) |
Умножая уравнение (2) на 6 и, суммируя, левые и правые части равновесий (1) и (2), приходим к суммарному уравнению реакции (3). Константы равновесий (1), (2) и (3) выражаются через их равновесные концентрации следующими равенствами:
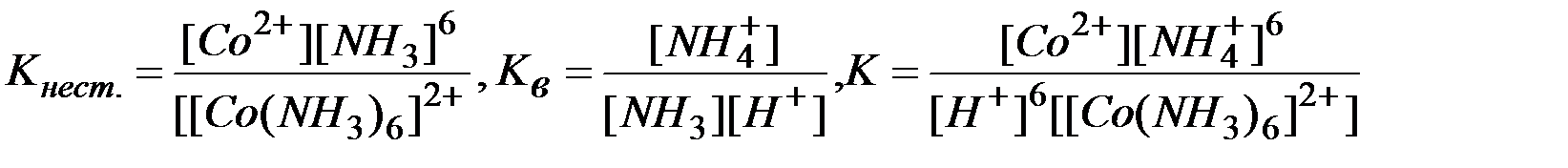
Сопоставляя эти выражения, можно видеть
К= Кнест..Кв6 (4)
Подставляя табулированные значения для Кнест. и Кв в выражение (4), имеем:
К = 7,8 . 10-6 . (1,73 . 109)6 = 2,09 . 1050
Полученное значение константы равновесия К очень велико. Это указывает на то, что суммарное равновесие (3) нацело смещено в правую сторону, т.е. комплекс [Co(NH3)6]2+ полностью разрушен.
Задача 7.Можно ли разрушить комплексное соединение [Ag(NH3)2]NO3 воздействием соли KI?
Решение.: Представим процесс разрушения комплекса системой простых равновесий (5) и (6):
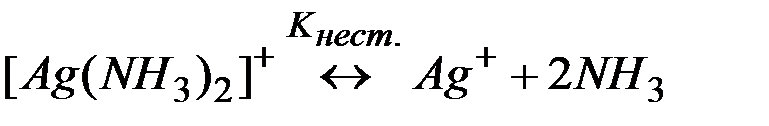 (1)
(1)
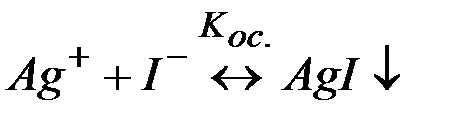 (2)
(2)
___________________________________________________________
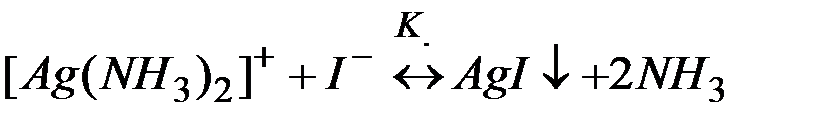 (3)
(3)
Суммирование левых и правых частей этих равновесий приводит к уравнению разрушения комплекса (3). По аналогии с вышеприведенными рассуждениями в задаче 6 можно показать, что
К = Кнест.. Кос. (4)
Подставляя в равенство (4) табулированное значение для Кнест.. и Кос.приходим к значению К:
К = 7,94 .10–8. 1016 = 7,94 . 108
Высокое значение константы К указывает на практически полное смещение равновесия (3) в правую сторону, т.е. комплекс [Ag(NH3)2]+ разрушен.
Задача 8. Можно ли разрушить комплексное соединение Na[Ag(CN)2] воздействием на него KCl? 
Решение: Процесс разрушения комплекса [Ag(CN)2]– можно представить равновесиями (1) и (2):
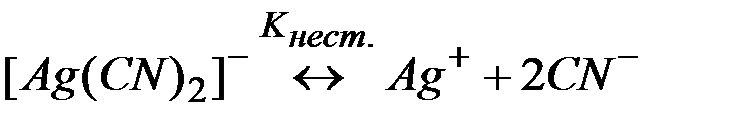 (1)
(1)
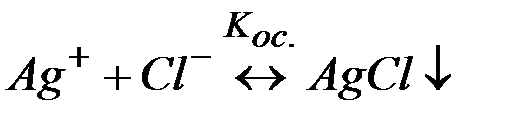 (2)
(2)
___________________________________________________________
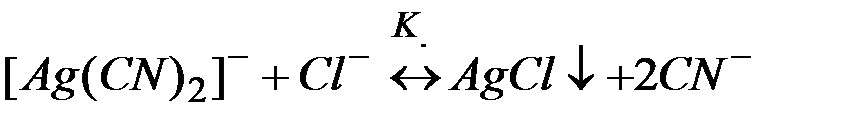 (3)
(3)
Суммирование левых и правых частей уравнений (1) и (2) приводит к равновесию разрушения комплекса (3). Можно показать, что
К = Кнест. . Кос.
При подстановке численных значений Кнест.и Кос. в последнее выражение имеем
К = 10–21. 0,912 . 1010 = 0.912 . 10–11
Низкое значение константы К указывает, что равновесие (3) практически полностью смещено в левую сторону. Таким образом, комплекс [Ag(CN)2]– невозможно разрушить воздействием анионов Cl–.
Задача 9.Напишите уравнение первичной диссоциации в водном растворе комплексной соли Ca2[Fe(CN)6]. В ответе укажите количество образующихся положительно заряженных ионов.
Решение: Первичная диссоциация комплексного соединения происходит с образованием ионов внешней сферы и комплексных ионов:
Ca2[Fe(CN)6]  2Ca2+ + [Fe(CN)6]4–
2Ca2+ + [Fe(CN)6]4–
При этом образуются два положительно заряженных иона (Ca2+).
Ответ: 2.
Задача 10.Напишите уравнение диссоциации комплексного иона [Zn(NH3)3CN]+. В ответе укажите общее количество ионов и молекул, образующихся при диссоциации.
Решение: Диссоциация комплексного иона (вторичная диссоциация) происходит с образованием иона комплексообразователя (иона Zn2+), а также лигандов (молекул NH3 и ионов CN–):
[Zn(NH3)3CN]+  Zn2+ + 3NH3 + CN– .
Zn2+ + 3NH3 + CN– .
Общее количество образовавшихся частиц (молекул и ионов) равно 5.
Ответ: 5.
Задача 11.Ион (NiCl4)2- парамагнитен, а ион [Ni(CN)4]2- - диамагнитен. Определить тип гибридизации АО иона Ni2+ и пространственную структуру каждого комплексного иона.
Решение: Электронная конфигурация иона Ni2+ … 3s23p63d8. Графическая схема заполнения электронами валентных орбиталей в соответствии с правилом Хунда имеет вид:
| 4s | 4p | ||
| 3d | ¯ | ¯ | ¯ | | |
Ион (NiCl4)2- - парамагнитен, следовательно, в нем сохраняются неспаренные электроны, а акцепторным орбиталям (эти орбитали обозначены
| |
служат одна 4s- и три 4р-орбитали иона Ni2+:
| 4s | 4p | ||
| 3d | ¯ | ¯ | ¯ | | |
Таким образом, образование иона (NiCl4)2- - сопоровождается sp3-гибридизацией АО никеля. Пространственная структура этого иона – тетраэдр.
В диамагнитном ионе [Ni (CN)4]2- - нет неспаренных электронов. Следовательно, при образовании этого иона происходит спаривание одиночных электронов иона Ni2+ с освобождением одной 3d-орбитали:
| 4s | 4p | ||
| 3d | ¯ | ¯ | ¯ | ¯ |
Теперь в качестве акцепторных выступают одна 3d-, одна 4s- и две 4р-орбитали:
| 4s | 4p | ||
| 3d | ¯ | ¯ | ¯ | ¯ |
Гибридизация акцепторных орбиталей (dsp2-гибридизация) приводит к плоско-квадратной структуре иона [Ni (CN)4]2-.
 Варианты контрольных заданий
Варианты контрольных заданий
Вариант 1
1. Дайте определение понятию "комплексные соединения". Объясните структуру этих соединений на примереPt(NH3)4Cl2]Cl2. Какова биологическая роль комплексных соединений?
2. Из сочетания частиц Cr3+, H2O, Cl− и К+ можно составить семь координационных формул комплексных соединений хрома, одна из которых [Cr(H2O)6]Cl3 . Составьте формулы других шести соединений и напишите уравнения их диссоциации в водных растворах.
Вариант 2
1. Проанализируйте изомерию комплексных соединений. Чем различаются между собой структурная изомерия и стереоизомерия? Дайте определение и приведите примеры для следующих видов структурной изомерии: ионизационной, гидратной, связевой, полимеризационной и координационной, а также стереоизомерии геометрической и оптической. Какие изомеры называются энантиомерами? Что представляет собой рацематная смесь энантиомеров?
2. Определите заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях [Cu(NH3)4]SO4, K2[PtCl6], K[Ag(CN)2]. Назовите их. Напишите уравнения диссоциации этих соединений в водных растворах.
Вариант 3
1. Дайте определение комплексному соединению. Являются ли идентичными термины «комплексное соединение» и «координационное соединение»? В чем заключается главное различие между комплексными соединениями и двойными солями? Можно ли ожидать, что ионы, на которые распадается в растворе двойная соль, будут участвовать в комплексообразовании, например, переходя в аква-комплексы?
2. Определите, чему равен заряд следующих комплексных ионов: [Cr(H2O)4Cl2], [HgBr4], [Fe(CN)6], если комплексообразователями являются Cr3+, Hg2+, Fe3+. Напишите формулы соединений, содержащих эти комплексные ионы. Назовите их.
Вариант 4
1. Назовите основные классы комплексных соединений (приведите примеры).
Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях:K2[PtCl6]; Cr(H2O)4Cl2]Cl; Na[Sb(SO4)2].Напишите уравнения диссоциации этих соединений в водных растворах.
2. Каково координационное строение соли? Какова степень окисления центрального атома и дентатность иона CO32-?
Вариант 5
1. Дайте определения понятиям: "внешняя и внутренняя сферы комплексного соединения", "координационное число комплексообразователя"; приведите примеры.
Определите, чему равен заряд следующих комплексных ионов: [Cr(H2O)4Cl2], [HgBr4], [Fe(CN)6], если комплексообразователями являются Cr3+, Hg2+, Fe3+. Чему равно координационное число комплексообразователя в этих ионах?
Напишите формулы комплексных соединений, содержащих эти комплексные ионы? Назовите эти соединения.
2. Хлорид серебра растворяется в растворах аммиака и тиосульфата натрия. Дайте этому объяснение и напишите молекулярные и ионно-молекулярные уравнения соответствующих реакций.
Вариант 6
1. Дайте краткую характеристику основных составных частей комплексного соединения, таких как внешняя сфера и внутренняя (координационная) сфера, комплексный ион и ионы внешней сферы, центральный атом (комплексообразователь) и лиганды. Как можно объяснить образование связей между комплексообразователем и лигандами с позиций взаимодействия кислоты и основания Льюиса? Могут ли в координационную сферу одного и того же атома комплексообразователя входить в качестве лигандов нейтральные молекулы и анионы одновременно? Что выражает координационное число?
2. Определите заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях [Cu(NH3)4]SO, K2[PtCl6],K[Ag(CN)2].Напишите уравнения диссоциации этих соединений в водных растворах.
Вариант 7
1. Как можно представить образование координационных связей с позиций метода
валентных связей? Какая взаимосвязь существует между геометрическими формами комплексных ионов и типами гибридизации орбиталей? Какие комплексы относят к высокоспиновым, а какие - к низкоспиновым? На чем основана методика прогноза парамагнитных и диамагнитных свойств комплексов?
2. Составьте координационные формулы следующих комплексных соединений кобальта: 3NaNO2∙Co(NO2)3; CoCl3∙3NH3∙2H2O; 2KNO2∙NH3∙Co(NO2)6. Координационное число кобальта (III) равно шести. Напишите уравнения диссоциации этих соединений в водных растворах.
Вариант 8
1. Какая ковалентная связь называется донорно-акцепторной? Какой атом или ион является донором, а какой - акцептором в следующих комплексных ионах:[H3O]+ , [Zn(NH3)4]2+, [BF4]− ?
Напишите формулы следующих комплексных соединений:тетрагидроксоалюминат (III) натрия,; гексацианоферрат (III) калия; дихлородинитроплатинат (II) натрия.
2. Определите заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях K4[Fe(CN)6], K4[TiCl8], K2[HgI4]. Назовите их. Как диссоциируют эти соединения в водных растворах?
Вариант 9
1. Из сочетания частиц Cr3+, H2O, Cl– и K– можно составить семь координационных формул комплексных соединений хрома, одна из которых [Cr(H2O)6]Cl3. Составьте формулы других шести соединений и напишите уравнения их диссоциации в водных растворах.
2. При действии уксусной кислоты на раствор соли Co(NO2)3·4NH3, в котором не обнаружено ионов кобальта и свободного аммиака, выявляется, что только один нитрит-ион разрушается с выделением оксидов азота. Измерение электрической проводимости показывает, что соль распадается на два иона. Каково строение этой соли?
Вариант 10
1. Какая существует взаимосвязь между величиной координационного числа и геометрической формой комплексов? Проявляется ли какая-либо роль электронной конфигурации ионов комплексообразователей в отношении предпочтения ими лигандов определенных видов? В чем заключается различие между мо-нодентатными и полидентатными лигандами? Какие лиганды называются хелатными? Приведите примеры полидентатных и хелатных лигандов. Какие особенности проявляются у амбидентатных лигандов при их координировании ионами (атомами) комплексообразователей?
2. Константы нестойкости комплексных ионов [Co(NH3)6]3+, [Fe(CN)6]4–, [Fe(CN)6]3– соответственно равны 6,2∙10–36; 1,0∙1–-37; 1,0∙10–-44. Какой из этих ионов является более прочным? Напишите выражения для констант нестойкости указанных комплексных ионов и формулы соединений, содержащих эти ионы.
Вариант 11
1. Какие комплексные соединения называют двойными солями? Напишите уравнения диссоциации солей K4[Fe(CN)6] и (NH4)2Fe(SO4)2 в водном растворе. В каком случае выпадает осадок гидроксида железа (II), если к каждой из них прилить раствор щелочи? Напишите молекулярное и ионно-молекулярное уравнения реакции.
2. Напишите выражения для констант нестойкости следующих комплексных ионов: [Ag(CN)2]–, [Ag(NH3)2]+, [Ag(SCN)2]–. Зная, что они соответственно равны 1,0∙10–21; 6,8∙10–8; 2,0∙10–11, укажите, в каком растворе, содержащем эти ионы, при равной молярной концентрации ионов Ag+ больше?
Вариант 12
1. Как метод валентных связей объясняет тетраэдрическое строение иона [Zn(NH3)4]2+ ? Почему координационное число Zn2+ равно четырем?
Составьте координационные формулы следующих комплексных соединений кобальта:CoCl3·6NH3; CoCl3·5NH3; CoBr3·4NH3·2H2O. Координационное число Co+3 равно шести. Напишите уравнения диссоциации этих соединений в водных растворах.
2. Составьте координационные формулы следующих комплексных соединений серебра: AgNO2·NaNO2. AgCl·2NH3. Координационное число серебра равно двум. Напишите уравнения диссоциации этих соединений в водных растворах.
Вариант 13
1. Какие константы равновесия используются в качестве количественных характеристик устойчивости комплексных соединений? Какое соотношение выполняется между ступенчатыми константами образования комплекса и его общей константой образования? Что характеризует константа нестойкости комплексного соединения и как от ее величины перейти к константе образования комплексного соединения или обратно? Как природа комплексообразователя и лигандов влияет на величину константы образования комплексного соединения?
2. Определите заряд следующих комплексных ионов: [Cr(NH3)5NO3], [Pt(NH3)Cl3], [Ni(CN)4], если комплексообразователями являются Cr3+,Pt2+, Ni2+. Напишите формулы комплексных соединений, содержащих эти ионы. Назовите их.
Вариант 14
1. Какие комплексные соединения называются изомерами? Приведите примеры гидратной,ионизационной и пространственной изомерии комплексных соединений. Назовите следующие комплексные соединения:[Co(NH3)6]2(SO4)3; K2[Ni(CN)4]; [Cu(NH3)4]Cl2.
2. Напишите уравнения диссоциации солей K3[Fe(CN)6] и NH4Fe(SO4)2в водном растворе. К каждой из них прилили раствор щелочи. В каком случае выпадает осадок гидроксида железа (III)? Напишите молекулярные и ионно-молекулярные уравнения реакций. Какие комплексные соединения называются двойными солями?
Вариант 15
1. Дайте определение понятию "константа нестойкости комплексного иона".
Напишите выражения для констант нестойкости следующих комплексных ионов: [Ag(CN)2]− ; [Ag(NH3)2]+; [Ag(SCN)2]−. Зная, что они соответственно равны 1,0·10−21 , 6,8·10−8 , 2,0·10−11, укажите, в каком растворе, содержащем эти ионы (при равной молярной концентрации), больше ионов Ag+.
2. Напишите формулы комплексных соединений, содержащих эти комплексные ионы, назовите эти соединения.
Вычислить концентрацию ионов Ag+ в 0,1М растворе [Ag(NH3)2]NO3, содержащем дополнительно 1 моль/л аммиака. Константа неустойчивости иона [Ag(NH3)2]+ составляет 5,7 ∙10 –8.
Вариант 16
1. Дайте определения понятиям: "константа нестойкости" и "произведение растворимости". Чем объяснить, что при действии хлорида калия на продукт взаимодействия нитрата серебра с аммиаком осадок AgCl не образуется, тогда как с иодидом калия образуется осадок AgJ? Напишите уравнения соответствующих реакций.
2. Из сочетания частиц Co3+, NH3, NO2– и K+ можно составить семь координационных формул комплексных соединений кобальта, одна из которых [Co(NH3)6](NO2)3. Составьте формулы других шести соединений и напишите уравнения их диссоциации в водных растворах.
Вариант 17
1. Приведите по два примера катионных, анионных и нейтральных комплексов. Укажите, чему равны степень окисления и координационное число комплексообразователя в каждом из них.
2. Составьте координационные формулы следующих комплексных соединений платины (II), координационное число которой равно четырем: PtCl2∙3NH3; PtCl2∙NH3∙KCl; PtCl2∙2NH3. Напишите уравнения диссоциации этих соединений в водных растворах. Какое из соединений является комплексным неэлектролитом?
Вариант 18
1. Какие комплексные соединения называют двойными солями?
Напишите уравнения диссоциации солей K4[Fe(CN)6] и (NH4)2Fe(SO4)2 в водном растворе. В каком случае выпадает осадок гидроксида железа, если к каждой из них прилить раствор щелочи? Напишите молекулярные и ионные уравнения соответствующих реакций.
2. Константы нестойкости комплексных ионов [Co(CN)4]2–, [Hg(CN)4]2–, [Cd(CN)4]2–соответственно равны 8∙10–20;4∙10–41; 1,4∙10–17. В каком растворе, содержащем эти ионы, при равной молярной концентрации ионов CN– больше?
Вариант 19
1.Написать формулы следующих соединений:
а) диамминтетраиодоплатина; б) пентамминфосфатокобальт.
2. Составьте координационные формулы следующих комплексных соединений платины: PtCl4∙6NH3; PtCl4∙4NH3; PtCl4∙2NH3. Координационное число платины (IV) равно шести. Напишите уравнение диссоциации этих соединений в водных растворах. Какое из соединений является комплексным неэлектролитом?
2. Определите заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях K4[Fe(CN)6], K4[TiCl8], Как диссоциируют эти соединения в водных растворах?
Вариант 20
Написать формулы следующих соединений:
а) триамминхлородинитрокобальт; б) триаквотрироданохром.
2. Из сочетания частиц Co+, NH3, NO–2 и К+ можно составить семь координационных формул комплексных соединений кобальта, одна из которых [Co(NH3)6](NO2)3. Cоставьте формулы других шести соединений и напишите уравнения их диссоциации в водных растворах.
Вариант 21
1.Написать формулы следующих соединений:
а) триамминтригидроксокобальт; б) диамминтрихлоронитроплатина.
2. Константы нестойкости комплексных ионов [Co)CN)4]2-, [Hg(CN)4]2-, [Cd(CN)4]2-соответственно равны 8∙10-20; 4·10-41; 1,4·10-17. В каком растворе, содержащем эти ионы, при равной молярной концентрации ионов CТ– больше?
Вариант 22
1. Определите заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях K2[HgI4]. K4[TiCl8]. Как диссоциируют эти соединения в водных растворах?
2. Напишите выражения для констант нестойкости комплексных ионов [Ag(NH3)2]+, [Fe(CN)6]4–, [PtCl6]2–. Чему равны степень окисления и координационное число комплексообразователей в этих ионах?
Вариант 23
1.Составьте координационные формулы следующих комплексных соединений кобальта: CoCl3∙6NH3; CoCl3∙5NH3; СoСl3∙4NH3. Координационное число кобальта (III) равно шести. Напишите уравнения диссоциации этих соединений в водных растворах.
2. Напишите выражения для констант нестойкости комплексных ионов [Ag(NH3)2]+, [Fe(CN)6]4-, [PtCl6]2-. Чему равны степень окисления и координационное число комплексообразователей в этих ионах?
Вариант 24
1. Составьте координационные формулы следующих комплексных соединений серебра: AgCl∙2NH3; AgCN∙KCN; AgNO2∙NaNO2. Координационное число серебра равно двум. Напишите уравнения диссоциации этих соединений в водных растворах.
2. Приведите по два примера катионных, анионных и нейтральных комплексов. Укажите, чему равны степень окисления и координационное число комплексообразователя в каждом из них.
Вариант 25
1. Какие комплексные соединения называют двойными солями? Напишите уравнения диссоциации солей K4[Fe(CN)6] и (NH4)2Fe(SO4)2 в водном растворе. В каком случае выпадает осадок гидроксида железа (II), если к каждой из них прилить раствор щелочи? Напишите молекулярное и ионно-молекулярное уравнения реакции.
2. При прибавлении раствора KCN к раствору [Zn(NH3)4]SO4 образуется растворимое комплексное соединение K2[Zn(CN)4]. Напишите молекулярное и ионно-молекулярное уравнения реакции. Константа нестойкости какого иона, [Zn(NH3)4]2+или [Zn(CN)4]2–, больше? Почему?
Вариант 26
1. Как можно представить образование координационных связей с позиций метода
валентных связей? Какая взаимосвязь существует между геометрическими формами комплексных ионов и типами гибридизации орбиталей? Какие комплексы относят к высокоспиновым, а какие - к низкоспиновым? На чем основана методика прогноза парамагнитных и диамагнитных свойств комплексов?
2. В растворе соли CoCO3Cl·4NH3 не обнаружены NH3, ионы Co+2и CO32-. Весь хлор, содержащийся в составе этой соли, образует AgCl. Измерение электрической проводимости приводит к заключению, что молекула соли распадается на два иона.
Вариант 27
1. Написать формулы следующих соединений:
а) триамминтрихлороиридий; б) триамминсульфитоплатина.
2. Константы нестойкости комплексных ионов [Co(NH3)6]3+, [Fe(CN)6]4–, [Fe(CN)6]3– соответственно равны 6,2∙10–36; 1,0∙1–-37; 1,0∙10–-44. Какой из этих ионов является более прочным? Напишите выражения для констант нестойкости указанных комплексных ионов и формулы соединений, содержащих эти ионы.
Вариант 28
1. Дайте определение комплексному соединению. Являются ли идентичными термины «комплексное соединение» и «координационное соединение»? В чем заключается главное различие между комплексными соединениями и двойными солями? Можно ли ожидать, что ионы, на которые распадается в растворе двойная соль, будут участвовать в комплексообразовании, например, переходя в аква-комплексы?
2. Составьте координационные формулы следующих комплексных соединений серебра: AgCl·2NH3; AgCN·KCN. Координационное число серебра равно двум. Напишите уравнения диссоциации этих соединений в водных растворах.
Вариант 29
1. Какие константы равновесия используются в качестве количественных характеристик устойчивости комплексных соединений? Какое соотношение выполняется между ступенчатыми константами образования комплекса и его общей константой образования? Что характеризует константа нестойкости комплексного соединения и как от ее величины перейти к константе образования комплексного соединения или обратно? Как природа комплексообразователя и лигандов влияет на величину константы образования комплексного соединения?
2. Составьте координационные формулы следующих комплексных соединений платины (II), координационное число которой равно четырем: PtCl2∙3NH3; PtCl2∙NH3∙KCl; PtCl2∙2NH3. Напишите уравнения диссоциации этих соединений в водных растворах. Какое из соединений является комплексным неэлектролитом?
Вариант 30
1. Дайте определение понятию "комплексные соединения". Объясните структуру этих соединений на примереPt(NH3)4Cl2]Cl2. Какова биологическая роль комплексных соединений?
2. Осмотическое давление миллимолярного раствора соли Fe(CN)2·4KCN составляет при 0ºС 11,2 кПа. На сколько ионов распадается молекула соли, если считать, что в разбавленном растворе соль диссоциирует полностью? Каково координационное строение соли, если раствор не обнаруживает реакций, характерных для ионов Fe2+ и CN–?
ХИМИЯ S- ЭЛЕМЕНТОВ
Вопросы, на которые необходимо обратить внимание при изучении темы (по лекционному материалу и рекомендуемой литературе):
I-А – подгруппа. Своеобразие строения атома водорода, физические и химические свойства этого элемента. Гидратация протона. Гидриды щелочных и щелочно-земельных элементов. Химические свойства воды. Вода как растворитель и лиганд. Щелочные металлы, их общие физико-химические свойства. Реакции с простыми и сложными веществами. Гидроксиды, соли и их растворы.
II-А – подгруппа. Щелочноземельные металлы, общие физико-химические свойства. Реакции с простыми и сложными веществами. Гидроксиды, соли и их растворы.
Вопросы темы, выносимые для самостоятельного изучения (сделать краткий конспект):
Вода, геометрия и свойства её молекулы, структура льда и жидкой воды, химические свойства воды, вода как растворитель и лиганд (для всех направлений).
Комплексы катионов натрия и калия с биомолекулами, катиониты и ионный обмен натрия и калия и других однозарядных ионов почвенного раствора. Натрий и калий как компоненты почвы и почвенных растворов. Калий как элемент питания растений, калийные удобрения, круговороты натрия и калия в природе. Роль магния в хлорофилле. Магний и кальций как питательные компоненты почв, их ионообменное поведение в почвах, жесткость воды, известкование и известкование почв (по направлению «Агрономия»)
Токсичность бериллия и его соединений.Комплексные соединения магния и кальция с хелатообразующими лигандами, Mg2+ и Са2+ в живой клетке.Mg2+ и Са2+ в ферментативных реакциях(по направленияю: «Ветеринарно-санитарная экспертиза»).
В периодической системе всего 14 s -элементов (включая водород и гелий). Это элементы I А и II А групп.
