So42- - анион i аналит.гр., водный раствор вас12
1.Реакция с катионами бария (фармакопейная).
Ва2+ + SO42- → BaSO4↓ (белый мелкокристаллический)
Выпадает белый осадок сульфата бария. Если в растворе присутствует перманганат калия КМО4, то осадок BaSO4 окрашивается в фиолетово - красный цвет за счет адсорбции МпО42+ - ионов на осадке.
BaSO4 не растворяется в минеральных кислотах, за исключением концентрированной H2SO4, в которой он частично растворим с образованием Ba(HSO4)2:
BaSO4 + H2SO4→Ba(HSO4)2
2.Реакция с катионами свинца.
РЬ2+ + SO42- →PbSO4↓. (белый кристаллический)
Осадок PbSO4 частично растворяется в минеральных кислотах; растворяется в щелочах и в водных растворах ацетатов натрия CH3COONa или аммония CH3COONH4 с образованием комплексных соединений:
PbSO4 + 4NaOH →Na2[Pb(OH)4] + Na2SO4
3. Реакция с родизонатом бария.
На листок фильтровальной бумаги наносят раствор ВаС12 и родизоната натрия или родизоновый кислоты. На бумаге возникает красное пятно родизоната бария. На это пятно наносят 1-2 капли раствора, содержащего сульфат - ионы (Na2SO4, K2SO4 или H2SO4 разбавленной). Пятно обесцвечивается.
6. Приведите уравнения реакций идентификации калия сульфита. Укажите аналитические эффекты реакций, особенности их выполнения. К каким аналитическим группам относятся катион и анион, входящие в состав соли? Укажите групповой реагент, аналитический эффект при действии группового реагента.
Калия сульфит
К+ - 1 анал.гр.катионов, групп. реагента нет
SO32- - 1 анал.гр.анионов,групп.реагент соли бария
1.Реакция с гексанитрокобальтатом натрия (желт.↓)
K2SO3 +Na3[Co(No2)6]→K2 Na[Co(No2)6]↓ +2NaCl
2.Реакция с Na гидротартратом (бел.крист.↓)
K2SO3 +NaHC4H4O6→K HC4H4O6↓+NaCl
3.K+→пламя фиолет.цвет
4. С солями бария (бел.крист.↓)
K2SO3+BaCl2→Ba SO3↓+2NaCl
5.Разложение кислотами( характер.запах)
K2SO3+2HCl→2KCl+H2O+SO2↑
6.С раствором йода (Ф)-обесцв.раствора
K2SO3+I2+H2O→ K2SO4+2KI
Приведите уравнения реакций идентификации натрия арсенита. Укажите аналитические эффекты реакций, особенности их выполнения. К каким аналитическим группам относятся катион и анион, входящие в состав соли? Укажите групповой реагент, аналитический эффект при действии группового реагента.
Натрия арсенит
Na+ -1 анал.гр.катионов, групп. реагента нет
AsO3- -1 анал.гр.анионов,групп.реагент соли бария
1.С цинкуранилацетатом (под микрскопом желт тетраэдрич. и октаэдр.кристалы)
NaAsO3+ Zn(UO2)3(CH3COO)8+CH3COOH→Na Zn(UO2)3(CH3COO)9+HAsO3
2. с гексагидроксостибатом калия (под микрос.белые кристаллы)
NaAsO3+K[Sb(OH)6]→ Na[Sb(OH)6]↓+ K AsO3
3.Na+→пламя желт.цвет
4. С солями бария (бел.крист.↓)
2 NaAsO3 +3BaCl2→Ba3(AsO3)2↓+ 6NaCl
5.Реакции с сульфид ионами в кислой среде (ф) –желт.осадок
6. C нитратом серебра (ф)
NaAsO3 + AgNO3→NaNO3+AgAsO3↓
Приведите уравнения реакций идентификации аммония сульфида. Укажите аналитические эффекты реакций, особенности их выполнения. К каким аналитическим группам относятся катион и анион, входящие в состав соли? Укажите групповой реагент, аналитический эффект при действии группового реагента.
Аммония сульфид
NH4+- 1 анал.гр.катионов, групп. реагента нет
S-2- 2 аналит.группа анионов.Группов.реагент AgNO3
1. Пары аммиака окрашив.красн.лакмус.бумагу в синий цвет
(NH4)2S +2NaOH→NH3↑+H2O+Na2S
2. С раствором Несслера(осад.красно-бур.аморфный)
(NH4)2S +2K2[HgI4]+4KOH→[NH2Hg2O]I↓+7KI+HCl+ H2O
3. C нитратом серебра(черный осадок)
(NH4)2S + AgNO3→Ag2S↓+2NH4NO3
4.С сильными кислотами(характер.запах сероводорода,фильтров.бумага пропитанная ацетатом свинца чернеет)
(NH4)2S +2HCl→H2S↑+2NH4Cl
Приведите уравнения реакций идентификации аммония роданида. Укажите аналитические эффекты реакций, особенности их выполнения. К каким аналитическим группам относятся катион и анион, входящие в состав соли? Укажите групповой реагент, аналитический эффект при действии группового реагента.
Аммония роданид
NH4+- 1 анал.гр.катионов, групп. реагента нет
SCN--2 аналит.группа анионов.Группов.реагент AgNO3
1. Р-ия с щелочами пары аммиака окрашив.красн.лакмус.бумагу в синий цвет
NH4 SCN+NaOH→ NH3↑+H2O+NaSCN
2.С раствором несслера (осад.красно-бур.аморфный)
NH4 SCN+2K2[HgI4]+4KOH→[NH2Hg2O]I↓+7KI+HCl+ 3H2O
3. C нитратом серебра(белый ос)
NH4 SCN+ AgNO3→Ag SCN↓+ NH4 NO3
4.С солями кобальта и 5-6к.диэтилов.эфира –встряхив.и верхний органич.слой окрашивается в синий цв.
4NH4 SCN+СoCl2→ (NH4)2[Co(SCN)4]+2NH4Cl
Приведите уравнения реакций идентификации висмута нитрата. Укажите аналитические эффекты реакций, особенности их выполнения. К каким аналитическим группам относятся катион и анион, входящие в состав соли? Укажите групповой реагент, аналитический эффект при действии группового реагента.
Висмут-катион 5 аналитической группы. Групповой реагент группы являются щелочи или гидроксид аммония, получаются гидроксиды металлов, нерастворимые в избытке реагента.
1. Реакция с щелочами и аммиаком: (BiС16)3- + 3 ОН- = Bi (ОН) 3 (белый) + 6 С1-
Осадок расворяется в минеральных кислотах. При нагревании желтеет вследствие образования оксогидроксида висмута (III): Bi (ОН) 3 = Bi ОН + Н2О
Реакция гидролиза: (BiС16)3- + Н2О = BiОСl (белый) + 2 НСl + 3 Сl-
Осадок не растворяется в растворах винной кислоты и ее солей.
3. Реакция с сульфид-ионами (фармакопейная)
(BiСl6)3- + 3 S2- = Bi2 S3(черно-коричневый) + 12 Сl-
в кислой среде. Осадок не растворяется в разбавленных минеральных кислотах, за исключением разбавленной HNO3, в которой он растворяется с выделением свободной серы:
Bi2S3 + 8 HNO3 = 2 Bi (NO3)3 + 2 NO + 2S + 4 H20
Осадок Bi2S3 растворяется в присутствии хлорида железа (III) FeCl3: Bi2S3+6 FeCl3 --> 2 BiCl3 + 6 FeCl2+ 3S
4.Реакция с иодидами (фармакопейная).
(BiС16)3- + 3 I- = Bi I3 (черный) + 6 Сl-
Дальнейшее прибавление избытка раствора KI приводит к растворению осадка и образованию оранжевого раствора:
Bil3 + I- = [Bil4]- (желто-оранжевый)
При прибавлении воды к этому раствору и его нагревании сначала выпадает осадок BiI3, который затем гидролизуется с образованием желто-оранжевого осадка оксоиодида висмута BiOI (иодида висмутила):
[Bil4]- + Н2О = BiOI + 3 I- + 2Н+.
5.Реакция восстановления висмута (III) до висмута (О) соединениями олова (II).
2 Bi(OH)3 + 3 [Sn(OH)4]2- = 2 Bi° +3 [Sn(OH)6]2-, pН=10.
Аналитические реакции нитрат - иона NO3-
Относитсяк 3-й аналитической группе.Группового реагента нет.
1.Реакция с дифениламином (фармакопейная).
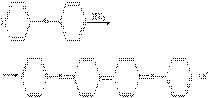
2.Реакция с металлической медью (фармакопейная).
Реакцию проводят в среде концентрированной H2SO4 при нагревании.
2KNO3 + 2H2SO4 + Cu --> K2SO4 + 2NO2 + CuSO4 + 2H2O ,жeлтo-бypыe пары
3.Реакция с сульфатом железа (II) и концентрированной серной кислотой.
Реакцию проводят при нагревании:
3Fe2+ + NO3- + 4H+ = 3Fe3+ + NO + 2H2O,
Fe2+ + NO = [FeNO]2+.(бурый)
Эту реакцию дает и нитрит - ион, поэтому нельзя открыть этой реакцией нитрат - ион в присутствии нитрит- иона. Проведению реакции мешают Вг-, Г, SO32-, S2O32', CrO42-, MnO42-.
4.Реакция с металлическим алюминием или цинком.
3 NO3- + 8 А1 + 5 ОН- + 18 Н2О -> 3 NH3 + 8 [Al (OH)4]-
Выделяющийся аммиак ощущается по запаху и окрашивает влажную красную лакмусовую бумагу в синий цвет.Проведению реакции мешают катионы аммония NH4+, выделяющие аммиак в щелочной среде, а также другие анионы, способные восстанавливаться до аммиака (NO2-, SCN-, ферро - и феррицианид -- ионы).
5.Реакция с антипирином. Реакцию проводят в кислой среде.
Приведите уравнения реакций идентификации магния сульфата. Укажите аналитические эффекты реакций, особенности их выполнения. К каким аналитическим группам относятся катион и анион, входящие в состав соли? Укажите групповой реагент, аналитический эффект при действии группового реагента.
Аналитические реакции катионов магния Mg 2+
V аналитической группы
Групповым реагентом на катионы V аналитической группы являются щелочи или гидроксид аммония, получаются гидроксиды металлов, нерастворимые в избытке реагента.
1. Реакция с щелочами и аммиаком: Mg2+ + 2 ОН- --> Mg(OH)2 (белый аморфный)
Mg2+ + 2 NH4 OH= Mg(OH)2 + 2 NH4+
Осадок не растворяется в щелочах, растворяется в НСl, H2SO4, CH3COOH: Mg(OH)2 + 2 Н+ -> Mg2+ + 2 Н2О
2. Реакция с гидрофосфатом натрия Na2HPO4 (фармакопейная).
Реакцию проводят в аммиачном буфере:
Mg2+ + HPO42- + NH4OH = MgNH4PO4↓ + H2O. (белый кристаллический) При проведении реакции в отсутствии катионов аммония и аммиака выпадает белый аморфный осадок MgHPO4. Избыток NH4 мешает выпадению NH4MgPO4. Осадок NH4MgPO4 растворяется в минеральных кислотах и в уксусной кислоте:
NH4MgPO4 + 3 НС1 - Н3РО4 + MgCl2 + NH4C1
NH4MgPO4+ 2 CHjCOOH = NH4H2PO4 + (CH3COO)2Mg
Проведению реакции мешают катионы Li+, Ca2+, Sr2, Ba2+ и др.
3. Реакция с магнезоном I - п - нитробензолазорезорцином.
В щелочной среде магнезон I, имеющий красную окраску, образует с катионами Мg2+,комплекс синего цвета, сорбирующийся на осадке Mg(OH)2:
При малых концентрациях Mg2+ осадок не выделяется, а раствор окрашивается в синий цвет. Проведению реакции мешают Cd2+, Sn2+, Cr3+, Fe2+, Co2+, Ni2+.
4.Реакция с 8- оксихинолином.
Реакцию проводят в аммиачной среде при рН = 8--13 (при нагревании).
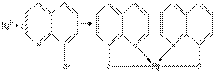
Осадок растворим в минеральных кислотах и в уксусной кислоте. Проведению реакции мешают катионы, также образующие комплексы с 8 -оксихинолином (Cu2+, Zn2+. Cd2+, Fe3+ и др.).
5. Реакция с хинализарином.
Реакцию проводят в щелочной среде. Образуется синий осадок комплексного соединения - хинализарината магния состава MgL(OH), где НL - условное обозначение молекулы хинализарина:
При небольшом содержании катионов Mg2+в растворе осадок не выпадает, а раствор окрашивается в цвет. Проведению реакций мешают катионы алюминия.
6. Реакция с растворимыми карбонатами (Nа2С03).
2 Mg2++ 2 Nа2С03 + Н2О = (МgОН)2С0з (белый аморфный) +4 Nа + СО2. Осадок (МgОН)2С0з,растворим в кислотах и в солях аммония.
7. Реакция с оксалатом аммония (NH4)С2О4.
Mg2++ (NH4)С2О4 = Mg С2О4 (белый) + 2 NH4
8. Катионы Mg2+ с дифенилкарбазидом (С6Н5 NHNH)2С0 образуют комплекс красно-- фиолетового цвета.
Аналитические реакции сульфат-иона SO42-
Анион первой аналитической группы,групповой реагент - хлорид бария ВаСl2 в нейтральном или слабощелочном растворе
1.Реакция с катионами бария (фармакопейная).
Ва2+ + SO42- --> BaSO4 (белый мелкокристаллический)
BaSO4 не растворяется в минеральных кислотах, за исключением концентрированной H2SO4, в которой он частично растворим с образованием Ba(HSO4)2:
BaSO4 + H2SO4->Ba(HSO4)2
2.Реакция с катионами свинца.
РЬ2т + SO42- -> PbSO4. (белый кристаллический)
Осадок PbSO4 частично растворяется в минеральных кислотах; растворяется в щелочах и в водных растворах ацетатов натрия CH3COONa или аммония CH3COONH4 с образованием комплексных соединений:
PbSO4 + 4 NaOH -- Na2[Pb(OH)4] + Na2SO4
3. Реакция с родизонатом бария.
На листок фильтровальной бумаги наносят каплю раствора ВаС12 и 1 каплю раствора родизоната натрия Na2C6Oe или родизоновый кислоты Н2Сб06. На бумаге возникает красное пятно родизоната бария. На это пятно наносят 1-2 капли раствора, содержащего сульфат - ионы (Na2SO4, K2~SO4 или H2SO4 разбавленной). Пятно обесцвечивается.
Приведите уравнения реакций идентификации ацетата ртути (I). Укажите аналитические эффекты реакций, особенности их выполнения. К каким аналитическим группам относятся катион и анион, входящие в состав соли? Укажите групповой реагент, аналитический эффект при действии группового реагента.
Hg22+
Вторая группа катионов.
1.Групповой реагент – соляная кислота.
Hg22+ + 2Cl- = Hg2Cl2↓.
Хлорид ртути взаимодействует с гидроксидом аммония, образуя хлорид меркураммония
[Hg(NH2)]Cl, и металлическую ртуть, вследствие чего осадок чернеет:
Hg2Cl2 + 2NH4OH = [Hg(NH2)]Cl↓ + Hg↓ + NH4Cl + 2H2O.
2. Катион ртути способен восстанавливаться в присутствии восстановителей (Sn2+, Cu) до металлической ртути:
Hg22+ + Sn2+ = 2Hg↓ + Sn4+;
Hg22+ + Cu = 2Hg↓ + Cu2+.
Образуется осадок черного цвета.
3.Реакция с солями йодистоводородной кислоты:
Hg22+ + 2I- = Hg2I2↓.
Образуется грязно-зеленый осадок йодида ртути (I), растворимый в избытке реагента с образованием тетраиодо(II)меркурата калия и черного осадка металлической ртути:
Hg2I2 + 2KI = K2[HgI4] + Hg↓.
4.Реакция со щелочами:
Hg22+ + 2OH- = Hg2O↓ + H2O.
В результате реакции образуется неустойчивый гидроксид ртути (I), разлагающийся на оксид ртути (I) черного цвета и воду.
5.Реакция с хроматом калия:
Hg22+ + CrO42- = Hg2CrO4v.
Образуется кирпично-красный осадок хромата ртути, растворимый в азотной кислоте.
ацетат - ион CH3COO'
Общего группового реагента нет. Анионы III группы
1.Реакция с хлоридом железа (III) (фармакопейная).
При рН = 5-8 ацетат - ион с катионами Fe(III) образует растворимый темно - красный (цвета крепкого .чая) ацетат или оксиацетат железа (III).
В водном растворе он частично гидролизуется; подкисление раствора минеральными кислотами подавляет гидролиз и приводит к исчезновению красной окраски раствора.
3 СНзСООН + Fe -->* (CH3COO)3Fe + 3 Н+
При кипячении из раствора выпадает красно-бурый осадок основного ацетата железа (III):
(CH3COO)3Fe + 2 Н2О <- Fe(OH)2 CH3COO + 2 СН3СООН
2.Реакция с серной кислотой.
Ацетат - ион в сильно кислой среде переходит в слабую уксусную кислоту, пары которой имеют характерный запах уксуса:
CH3COO- + H+ =CH3COOH.
3.Реакция образования уксусноэтилового эфира (фармакопейная).
CH3COO- + H+ =CH3COOH,
CH3COOH + C2H5OH → CH3COOC2H5 + H2O.
В кислой среде выделяется уксусная кислота, которая со спиртами образует летучие эфиры, обладающие характерным запахом.
Приведите уравнения реакций идентификации сульфида стронция. Укажите аналитические эффекты реакций, особенности их выполнения. К каким аналитическим группам относятся катион и анион, входящие в состав соли? Укажите групповой реагент, аналитический эффект при действии группового реагента.
Sr2+-Третья группа катионов. Групповой реагент - разбавленная серная кислота и ее соли, образующие с катионами данной группы малорастворимые сульфаты, нерастворимые в воде, кислотах и щелочах:
1. Sr2+ + SO42- = SrSO4↓.
2.Окрашивание пламениЛетучие соли стронция окрашивают пламя горелки в карминово-красный цвет.
3. Карбонат аммония (NH4)2CO3 При взаимодействии с растворами солей стронция осаждает карбонат стронция белого цвета, растворимый в уксусной, соляной и азотной кислотах:
SrCl2 + (NH4)2CO3 = SrCO3+ 2NH4Cl
4. Насыщенный раствор гипса CaSO4 . 2H2O (гипсовая вода) образует с ионами Sr2+ белый осадок сульфата стронция:
Sr2+ + SO42- = SrSO4
Сульфид-ион:вторая аналитическая группа. Групповой реагент - Нитрат серебра AgNO3 и присутствии HNO3
1. 2Ag+ + S2- = Ag2S↓ Черный
2. Реакция с кислотами
Na2S + H2SO4 = H2S + Na2SO4.
Выделение сероводорода легко обнаружить по запаху или по почернению бумажки, смоченной раствором ацетата свинца:
Pb(CH3COOH)2 + H2S = PbS + 2CH3COOH.
3. Реакция с солями кадмия
Na2S + Cd(NO3)2 = CdS + 2NaNO3.
При добавлении к раствору, содержащему сульфид-ион, солей кадмия образуется желтый осадок сульфида кадмия.
4. Реакция с нитрозопентациано(II)ферратом натрия (нитропруссидом натрия)
Na2[Fe(CN)5NO] + Na2S = Na4[Fe(CN)5NOS].
Раствор окрашивается в красно-фиолетовый цвет вследствие образования комплекса
5. Реакция с нитратом серебра:
S2- + 2Ag+ = Ag2S↓.
Нитрат серебра образует с сульфид-ионом черный осадок сульфида серебра, нерастворимый в NH4OH, Na2S2O3 и KCN, но растворимый при нагревании в 2 М HNO3. Мешающих обнаружению анионов нет.
6. Реакция с гидроксокомплексом свинца Pb(OH)42-:
Pb2+ + 2OH- = Pb(OH)2↓,
Pb(OH)2 + 2OH- = Pb(OH)42-,
S2- + Pb(OH)42- = PbS + 4OH-.
Гидроксокомплекс свинца образует с сульфид-ионом черный осадок PbS, растворимый при нагревании в 2 М HNO3:
3PbS + 8HNO3 = 3Pb(NO3)2 + 3S + 2NO + 4H2O.
Приведите уравнения реакций идентификации калия фосфата. Укажите аналитические эффекты реакций, особенности их выполнения. К каким аналитическим группам относятся катион и анион, входящие в состав соли? Укажите групповой реагент, аналитический эффект при действии группового реагента.
Катион калия
I Аналитическая группа характеризуется отсутствием группового реагента
1 . Реакция с гидротартратом натрия или (винной кислотой) в присутствии ацетата натрия (рН=7)
K+ + HC4H4O6- = KHC4H4O6↓.бел. крист.
2. Реакция с гексанитрокобальтатом (III) натрия (рНлюбая кроме сильных кислот и сильных щелочей, т.к. реагент разлагается)
2K+ + Na3[Co(NO2)6] = NaK2[Co(NO2)6]↓ + 2Na+. желт, крист.,
Реакция с гексанитрокупратом (II) натрия и свинца.
2К+ + Na2Pb[Cu(NO2)6] = K2Pb[Cu(NO,)6] | черн. кубические крист. + 2Na+
4. Окрашивание пламени газовой горелки - в фиолетовый цвет.
Фосфат-ион
анион I аналитической группы-глорид бария BaCl2 или нитрат бария Ba(NO3)2. При взаимодействии анионов первой группы с катионом бария в растворе образуются осадки соответствующих бариевых солей:
1.Реакция с ВаС12.
2 РО43- + 3 Ва2+ -= Ва3(РО4)2 (белый)
НРО42- + Ва2+ -+ ВаНРО4 (белый)
В аммиачной среде реакция гидрофосфат- ионов с катионами бария приводит к образованию осадка среднего ортофосфата бария Ва3(РО4)2:
2 НРО42- + 3 Ва2+ + 2 NH3 -> Ва3(РО4)2 + 2 NH4+
Свежеосажденный осадок Ва3(РО4)2 растворяется в FfNO3, HC1, СН3СООН.
2.Реакция с нитратом серебра (фармакопейная).
Реакцию проводят в нейтральной среде:
РО43- + 3 Ag+ -> Ag3PO4 (желтый)
Осадок растворяется в азотной кислоте, в концентрированном аммиаке.
3.Реакция с магнезиальной смесью (фармакопейная)
Гидрофосфат - ион НРО42~ при взаимодействии с магнезиальной смесью (MgCI2 + NH4CI + NH3) образует белый мелкокристаллический осадок магнийаммонийфосфата NH4MgPO4:
HPO42- + NH4OH + Mg2+ = MgHPO4↓ + H2O.
4. Реакция с молибдатом аммония (фармакопейная). Реакцию проводят в азотнокислой среде при нагревании:
PO43- + NH4+ + 12MoO42- + 24H+ = (NH4)3P(Mo3O10)4↓ + 12H2O.
Выпадает желтый осадок фосфоромолибдата аммония.
Эта формула к первому разделу к 10 вопросу к нитритомерии.
Нитритометрическое определение стрептоцида основано на реакции диазотирования:
NH2 N ≡N+
 + NaNO2 + НС1 ↔
+ NaNO2 + НС1 ↔ 

 Сl - + NaC1+ 2Н2О
Сl - + NaC1+ 2Н2О
SO3H SO3H
