Химические свойства. Изменение окраски кислотно-основных индикаторов
Изменение окраски кислотно-основных индикаторов
Горячая, концентрированная селеновая кислота способна растворять золото, образуя красно-желтый раствор селената золота(III):
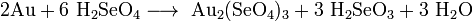
Для получения безводной кислоты в твердом кристаллическом состоянии полученный раствор выпаривают при температуре ниже 140 °C (413 К, 284 °F) в вакууме.
Концентрированные растворы данной кислоты вязки. Известны кристаллические моно- и дигидраты. Моногидрат плавится при 26 °C, дигидрат при −51,7 °C.
В ряду H2SО4 – H2SeО4 – H2ТeО4 (H6ТeО6) кислотные свойства
уменьшаются. Селеновая кислота H2SeО4 – белое кристаллическое вещест-
во, жадно притягивающее влагу. Селеновая кислота менее устойчива, чем
серная кислота, поэтому она более сильный окислитель, чем H2SО4 . Селе-
новая кислота обугливает органические вещества. Окислительные свойства
теллуровой кислоты слабее, чем у серной кислоты. Концентрированная
серная кислота не окисляет концентрированную соляную кислоту, селено-
вая кислота окисляют НС1 с выделением свободного хлора:
H2SeО4 + 2 НС1 = H2SeО3 + С12 + Н2О
За счет выделения атомарного хлора смесь селеновой и соляной кислот
растворяет золото и платину.
H2SeО4 при нагревании не разлагается с образованием триоксида селе-
на, его получают при взаимодействии селената натрия с избытком оксида
серы (VI):
Nа 2SeО4 + SО3 = Nа 2SО4 + SeО3
При нагревании теллуровая кислота разлагается:
H6ТeО6 = ТeО3 + 3 Н2О (при нагревании до 300 оС)
2 ТeО3 = 2 ТeО2 + О2 (при нагревании > 300 оС)
ТeО3 – порошок желтого цвета, не растворяется в воде, а также в разбав-
ленных растворах кислот и щелочей. Триоксид теллура растворяется толь-
ко в концентрированных водных растворах щелочей:
ТeО3 + 2 NаОН = Nа2ТeО4 + Н2О
Соли селеновой кислотылегко образуются при действии хлора на щелочные растворы селенитов или сплавлении селенитов с КNО3. Из реакционной смеси обычно выделяют малорастворимый (около 2•104 моль/л при обычных условиях) ВаSеО4, обменным разложением которого с сульфатами других металлов можно получать их селенаты. Последние в общем похожи на соответствующие сульфаты, но лучше растворимы в воде и менее устойчивы по отношению к нагреванию.
Производным селеновой кислоты является также имеющий суммарную формулу Sе2О5 селенат селенила — (SеО)SеO4, по способу образования и свойствам аналогичный его сульфату. Удобнее получать это бесцветное кристаллическое вещество выдерживанием расплавленного SеО3 при 170 С или взаимодействием SеО3 с SеО2 в жидкой SO2. В высоком вакууме он при 145 С возгоняется без разложения, а выше 185 С переходит в SеО2.
Соли - теллураты. Получают также сплавлением оксида теллура(IV) со щелочами в присутствии окислителей, сплавлением теллуровой кислоты с карбонатом или оксидом металла. Теллураты щелочных металлов растворимы. Применяются как сегнетоэлектрики, ионообменники, компоненты люминисцирующих составов.
