Приклад 3. Визначити валентні електрони елементів атома Mn
Розв’язання. Електрони на останньому рівні та попередньому підрівні, якщо він незаповнений, - валентні.
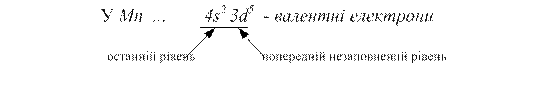
Приклад 4. Записати електронні формули атомівMn у збудженому стані та визначити їх максимальну валентність.
Розв’язання. Валентні електрони Mn ...3d54s2 можна графічно відобразити
Mn0 + hʋ → Mn*
| ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ |  | ↑ | ||||||
| 3d | ↑↓ | 3d | ↑ | 4p | |||||||||||||
| 4s | 4s |
Звідси бачимо, що на 4s орбіталі маємо 2 спарених електрона. Якщо додати квант енергії, то їх можна розпарувати, тобто один з електронів перевести на більш високий підрівень. На слідуючому 4р підрівні маємо вільні енергетичні комірки. Туди після одержання додаткової енергії перейде один електрон з 4s-орбіталі і отримаємо збуджений стан атому Мn*
Mn0 …3d5 4s2 + hʋ → Mn* …3d5 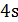 14p1
14p1
У збудженому стані атома зростає валентність. Вона визначається по кількості неспарених електронів. Для Мn * валентність дорівнює 7.
Збуджених станів може бути декілька. Це залежить від кількості пар спарених електроніз
Приклад 5. Записати електронні формули йонів з характерним ступенем окиснення для їх атомів.
Розв’язання. Йони утворюються коли атом приймає чи віддає електрони. Атом Мn не може прийняти електрони, бо зовнішній підрівень 4s у нього заповнений - на ньому 2 електрони. А попередній 3d підрівень, на якому 5 електронів не може приймати електрони, бо він закритий - «екранований» зовнішніми 4s - електронами. Тому атом Мn може тільки віддавати електрони. Електрони покидають зовнішні орбіталі, завжди їх повністю звільнюють
Mn0 – 2 ͞e̶ → Mn2+
| ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | |||||
| 3d | ↑↓ | 3d | ||||||||||||
| 4s | 4s |
Mn0 …3d5 4s2 – 2 ͞e → Mn2+…3d5 4s0
Mn0 …3d5 4s2 – 3 ͞e → Mn3+…3d4 4s0
Mn0 …3d5 4s2 – 4 ͞e → Mn3+…3d3 4s0
Mn0 …3d5 4s2 – 5 ͞e → Mn3+…3d2 4s0
Mn0 …3d5 4s2 – 6 ͞e → Mn3+…3d1 4s0
Mn0 …3d5 4s2 – 7 ͞e → Mn3+…3d04s0
Звідси зрозуміло, що у Мn можуть бути 7 ступенів окиснення: Мn0, Мп+2, Мn+3,Мn+4,Мn+5, Мn+6, Мn+7.
Завдання для самостійної роботи
1. Записати електронні формули атомів.
2. Згідно правилам Клечковського підтвердити порядок заповнення енергетичних рівнів та підрівнів.
3. Визначити валентні електрони елементів.
4. Записати електронні формули атомів у збудженому стані та визначити їх валентність.
5. Записати електронні формули йонів з характерним ступенем окиснення для їх атомів.
| Варіант | Елементи | Варіант | Елементи |
| Si та Y | In та Se | ||
| Cl та Sc | Ge та O | ||
| Zn та S | As та Cd | ||
| Al та I | Ag та Ti | ||
| Cu та C | Ag та Mg | ||
| Sn та P | Au та Na | ||
| Tl та Ar | Ag та B | ||
| K та Zr | Sr та As | ||
| Pb та F | Cr та In |
ТЕМА 3. ПЕРІОДИЧНИЙ ЗАКОН Д.І. МЕНДЕЛЕЕВА
Питання для самоперевірки
1. Занотуйте формулювання періодичного закону Д.І. Менделєєва в сучасній редакції та редакції Д.І. Менделєєва.
2. Вкажіть фізичний зміст номеру періоду. ?
3. Що таке група, чому вона поділяється на підгрупи?
4. Вкажіть фізичний вміст номера групи?
5. Який фізичний зміст порядкового номера елемента?
6. Як змінюються металеві та не металеві властивості елементів у групах?
7. Чим відрізняються елементи головних та побічних підгруп?
8. Де розміщуються валентні електрони у елементів головних та побічних підгруп? Що об'єднає елементи головних та побічних підгруп?
