Поверхнева активність
Для характеристики речовин, а точніше їх здатності впливати на поверхне-вий натяг розчинів вибрана величина, яка називається поверхневою активністю
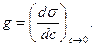 (3)
(3)
Тобто, поверхнева активність це міра здатності речовин при внесенні в розчинник знижувати його поверхневий натяг. Іншими словами – це та найменша концентрація ПАР, яка спричинює видиму зміну поверхневого натягу розчинника. Поверхнева активність позначається буквою g, часом можна зустріти в літературі і таке позначення, як G (символ вибраний в честь ученого Гіббса, який значну частину свого життя присвятив термодинамічним дослідженням поверхневого шару). Умовна розмірність цієї величини Гіббс.
Поверхнева активність є важливою фізико-хімічною характеристикою речовин такою самою, як діелектрична проникність, густина та ін. Вона залежить від природи речовини. Ця величина, зазвичай збільшується при зменшенні полярності (для водних розчинів). У органічних кислот g вища, ніж у солей цих речовин. Для молекул із великим числом полярних груп значення g дуже малі, або близькі до нуля, як от цукрів.
При дослідженні адсорбційної здатності речовин на межі розділу розчин-повітря вченими Дюкло і Траубе була встановлена чітка залежність g від довжини вуглеводневого радикалу членів гомологічного ряду, наприклад карбонових кислот, спиртів, амінів та ін. (див. рис. 1). Встановлена закономірність носить назву правила Дюкло-Траубе і звучить наступним чином: поверхнева активність речовин – членів гомологічного ряду зростає в 2¸4 рази при видовженні вуглеводневого радикалу на одну СН2 групу. Це правило стосується також і інших властивостей як от адсорбційна здатність, миюча, диспергуюча та емульгуюча дія та багатьох інших.
Як видно із рис. 1, збільшення концентрації ПАР в розчині спричинює зниження його поверхневого натягу. Таке зниження триває до досягнення розчином поверхневого натягу рівного поверхневому натягу рідкого ПАР. Зазвичай для молекулярних ПАР зниження поверхневого натягу відбувається дуже повільно, тобто необхідні великі кількості ПАР для помітного зниження поверхневого натягу.
Правило Дюкло-Траубе відіграло важливу роль у створенні великої кількості ПАР для різних потреб побуту, техніки та промисловості.

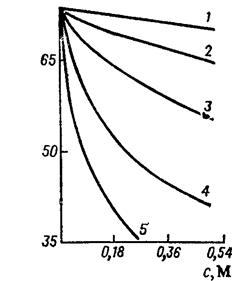
Рис. 1. Ізотерми поверхневого натягу карбонових кислот: 1 – мурашина, 2 – оцтова, 3 – пропіонова, 4 – масляна, 5 – ізовалеріанова
