Типичные реакции оснований
Билет 1.
1. Основные химические понятия (на примере любой химической формулы).
5Н2О
1. Сложное вещество – состоит из разных химических элементов.
2. 5 (коэффициент) молекул сложного вещества.
3. Качественный состав сложного вещества – состоит из водорода и кислорода.
4. Количественный состав 1 молекулы: 2 атома Н и один атом О; 5 молекул: 10 атомов Н и 5 атомов О.
5. Молярная масса М (Н2О) = 1*2 + 16 = 18 г/моль
6. Масса 5 молекул m (Н2О) = 5 * 18 = 90 г
7. Массовая доля водорода в молекуле: w = 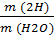 =
= 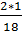 = 0, 3333 (33,33%)
= 0, 3333 (33,33%)
2. Подгруппа кислорода: строение и свойства атомов, простых веществ, химические свойства серы.
Элементы подгруппы кислорода — кислород О, сера S, селен Se, теллур Те, полонии Ро — имеют общее название «халькогены», что означает «рождающие руды».
Строение и свойства атомов.
Атомы серы, как и атомы кислорода и всех остальных элементов главной подгруппы VI группы Периодической системы Д. И. Менделеева, содержат на внешнем энергетическом уровне 6 электронов, из которых 2 электрона неспаренные.
Простые вещества.Аллотропия кислорода – это простые вещества кислород О2 и озон О3.
Для серы, как и для кислорода, характерна аллотропия. Это ромбическая и пластическая сера.
Химические свойства.Сера может быть и окислителем и восстановителем.
1.По отношению к восстановителям - водороду, металлам сера проявляет окислительные свойства и приобретает степень окисления -2. При обычных условиях сера реагирует со всеми щелочными и щелочноземельными металлами, медью, ртутью, серебром, например:
0 0 +2-2
Hg + S = HgS.
Н2 + S = H2S↑.
2. Однако по сравнению с кислородом и фтором сера является восстановителем, образуя соединения со степенью окисления +4, +6.
Сера горит синеватым пламенем, образуя оксид серы (IV):
S + О2 = SО2.
Это соединение широко известно под названием сернистый газ.
3. Расставьте коэффициенты в схемах реакций методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления.
Са + N2 ®Ca3N2
Сu + Н2SO4(конц)® CuSO4+ SO2+ H2O
При подготовке к экзамену решение см. в лабораторном журнале - практическая работа № 2.
Билет 2.
1. Открытие Д.И. Менделеевым Периодического закона. Периодическая система химических элементов.
Д. И. Менделеев расположил все известные ко времени открытия Периодического закона химические элементы в ряд,по возрастанию их атомных масс и отметил в нем отрезки — периоды, в которых свойства элементов и образованных ими веществ изменялись сходным образом, а именно (в современных терминах):
1) металлические свойства ослабевали;
2) неметаллические свойства усиливались;
3) степень окисления элемента в высших оксидах увеличивалась с +1 до +7;
4) оксиды от основных через амфотерные сменялись кислотными;
5) гидроксиды от щелочей через амфотерные гидроксиды сменялись все более сильными кислотами.
На основании этих наблюдений Д. И. Менделеев в 1869 г. сделал вывод — сформулировал Периодический закон:
Свойства химических элементов и образованных имивеществ находятся в периодической зависимости от их атомных весов.В современной формулировкеатомные массы элементовзаменены назаряд ядра.
2. Подгруппа углерода: строение и свойства атомов углерода, простых веществ, образованных углеродом, химические свойства углерода.
Подгруппа углерода (4 группа А) – углерод, кремний, германий, олово, свинец.
Углерод С — первый элемент главной подгруппы IV группы Периодической системы Д. И. Менделеева. Его атомы содержат на внешнем энергетическом уровне 4 электрона, поэтому они могут принимать четыре электрона, приобретая при этом степень окисления -4, т. е. проявлять окислительные свойства и отдавать свои электроны более электроотрицательным элементам, т. е. проявлять восстановительные свойства, приобретая при этом степень окисления +4.
Углерод — простое вещество.Углерод образует аллотропные модификации — алмаз и графит. Сходное с графитом строение имеют сажа и древесный уголь. Уголь благодаря своей пористой поверхности обладает способностью поглощать газы и растворенные вещества. Такое свойство некоторых веществ называется адсорбцией.
Химические свойства углерода.
Алмаз и графит соединяются с кислородом при очень высокой температуре. Сажа и уголь взаимодействуют с кислородом гораздо легче, сгорая в нем. Но в любом случае результат такого взаимодействия один — образуется углекислый газ:
С + O2 = СO2
С металлами углерод при нагревании образует карбиды, например:
4Аl + 3С = Аl4С3
3. Докажите с помощью характерной реакции наличие иона карбоната в карбонате натрия.
CO32-+ H+ (любая кислота) ® CO2 +H2O
Выделяется тяжелый бесцветный газ, который гасит горящую спичку.
Билет 3.
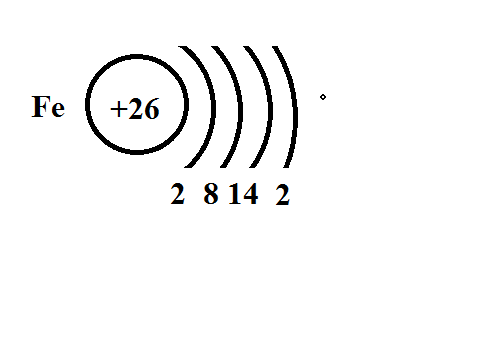
1. Теория строения атома: планетарная модель строения атома, распределение электронов по энергетическим уровням на примере элемента главной и побочной подгруппы.
Планетарная модель атома (модель Резерфорда)
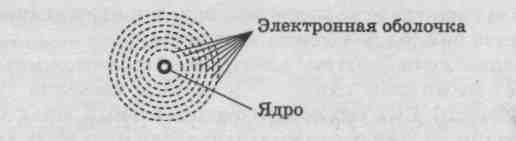 |
Ядро: протоны (р+) и нейтроны (n0).
Понятие об электронной оболочке атома ( электронных слоях, энергетических уровнях)
В электронной оболочке различают слои, на которых будут располагаться электроны с различным запасом энергии, поэтому их называют также энергетическими уровнями.
Число этих уровней в атоме химического элемента = соответствующему ему номеру периода в таблице Д. И. Менделеева:
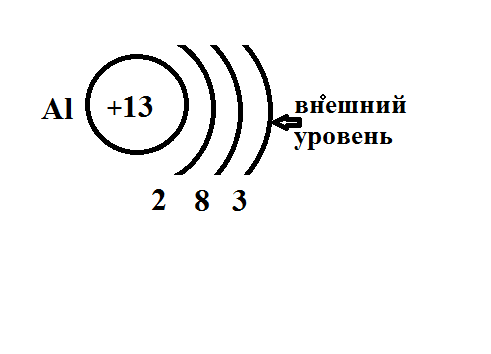
у атома Аl, элемента 3 периода, - три уровня. Каждый уровень может вместить в себя определенное максимальное число электронов: 1-й — 2е-, 2-й — 8е-, и, хотя максимальное число электронов, способных поместиться на 3- уровне, равно 18, атомы элементов этого периода могут разместить на нем, подобно атомам элементов 2 периода, только 8е-.
Энергетические уровни, содержащие максимальное числ электронов, называются завершенными.Если они содержат меньшее число электронов, то эти уровни незавершенные.
У элементов побочных подгрупп на внешнем уровне всегда 2 электрона (исключение Cr и Cu, у них 1 электрон). В последнюю очередь заполняется предвнешний уровень:
2. Подгруппа галогенов: строение и свойства атомов.
Элементы главной подгруппы VII группы Периодической системы Д. И. Менделеева, объединенные под общим названием галогены, фтор F, хлор Сl, бром Вr, йод I, астат At (редко встречающийся в природе) — типичные неметаллы. Это и понятно, ведь их атомы содержат на внешнем энергетическом уровне семь электронов, и им недостает лишь одного электрона, чтобы завершить его. Атомы галогенов при взаимодействии с металлами принимают электрон от атомов металлов. При этом образуются соли. Отсюда и происходит общее название подгруппы «галогены», т. е. «рождающие соли».
Галогены — очень сильные окислители. Фтор в химических реакциях проявляет только окислительные свойства, и для него характерна только степень окисления -1 в соединениях. Остальные галогены могут проявлять и восстановительные свойства при взаимодействии с более электроотрицательными элементами — фтором, кислородом, азотом. При этом степени их окисления могут принимать значения +1, +3, +5,
+7. Восстановительные свойства галогенов усиливаются от хлора к йоду, что связано с увеличением радиусов их атомов: атомы хлора примерно в полтора раза меньше, чем у иода.
Галогены — простые вещества.Все галогены существуют в свободном состоянии в виде двухатомных молекул F2, Cl2, Вr2, I2. Фтор и хлор - газы, бром — жидкость, йод — твердое вещество. От F2 к I2 усиливается интенсивность окраски галогенов. У кристаллов йода появляется металлический блеск.
3. Докажите с помощью характерной реакции наличие иона сульфата в сульфате натрия.
SO42- + Ba2+ (растворимая соль бария) ® BaSO4¯
Белый мелкокристаллический осадок
Билет 4.
1. Правила определения степеней окисления.
Элементы, которые имеют постоянную степень окисления:
1. I группа А: Li+, Na+, K+, Rb+, Cs+.
2. II группа А: Be+2, Mg+2, Ca+2, Zn+2, Sr+2, Cd+2, Ba+2.
3. IIIгруппа А: Al+3
4. F-
5. O-2
6. H+1 (МеН-1)
7. У простых веществ с.о. = 0.
У остальных элементов с.о. считают
H2+1SхO4-2 : так у серы нет постоянной с.о., поэтому принимаем ее за х.
+1*2 + х + (-2) * 4 = 0
х = +6
Высшая с.о. = № группы (исключение О, F)
Низшая с.о. = № группы – 8 (у Ме нет низшей с.о.)
2. Химические свойства галогенов – простых веществ.
Химическая активность галогенов, как неметаллов, от фтора к йоду ослабевает.
Каждый галоген является самым сильным окислителем в своем периоде. Окислительные свойства галогенов отчетливо при их взаимодействии с металлами. При этом образуются соли. Так, фтор уже при обычных условиях реагирует с большинством металлов, а при нагревании — и с золотом, серебром, платиной, известными своей химической пассивностью. Алюминий и цинк в атмосфере фтора воспламеняются:
0 0 +2 -1
Zn + F2 = ZnF2.
Остальные галогены реагируют с металлами в основном при нагревании.
Об уменьшении окислительных и увеличении восстановительных свойств галогенов от фтора к йоду можно судить и по их способности вытеснять друг друга из растворов солей.
Так, хлор вытесняет бром и йод из растворов их солей, например:
0 +1 -1 +1-1 0
Сl2 + 2NaBr = 2NaCl + Br2.
3. Составьте молекулярные и ионные уравнения реакций между веществами: нитратом свинца (II) и сульфатом калия, хлоридом железа (III) и нитратом серебра.
При подготовке к экзамену решение см. в лабораторном журнале - практическая работа № 1.
Билет 5.
1. Классификация химических реакций по числу исходных веществ и продуктов реакции.
| Тип реакции | Число исходных веществ | Число продуктов реакции |
| 1. Соединения | А + В + С → | АВС 1 сложное вещество |
| 2. Разложения | АВС → 1 сложное вещество | А + ВС |
| 3. Замещения | А + ВС → 1 простое + 1 сложное | АС + В 1 простое + 1 сложное |
| 4. Обмена | АВ + СD → 2 сложных | АD + СВ 2 слоржных |
2. Галогеноводороды и галогеноводородные кислоты и их соли.
Н2 + Г2 = 2НГ
(Г — условное химическое обозначение галогенов).
Все галогеноводороды (общую формулу их можно записать как НГ) — бесцветные газы, с резким запахом, токсичны. Очень хорошо растворяются в воде и дымятся во влажном воздухе, так как притягивают находящиеся в воздухе водяные пары, образуя при этом туманное облако.
Растворы галогеноводородов в воде являются кислотами, это HF — фтороводородная, или плавиковая, кислота, HC1 — хлороводородная, или соляная, кислота, НВr — бромоводородная кислота, HI — йодоводородная кислота. Самая сильная из галогеноводородных кислот — йодоводородная, а самая слабая — фтороводородная.
Соли галогеноводородных кислот.Галогеноводородные кислоты образуют соли: фториды, хлориды, бромиды и йодиды. Хлориды, бромиды и йодиды многих металлов хорошо растворимы в воде.
Для определения в растворе хлорид-, бромид- и йодид- ионов и их различения используют реакцию с нитратом серебра.
3. Вычислить массовую долю кислорода в сульфате натрия.
| Дано: Na2SO4 | Решение: WO = 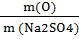 = = 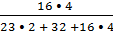 = = 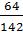 WO = 0,451 =45,1% WO = 0,451 =45,1% |
| WO- ? % |
Ответ: массовая доля кислорода 45,1%.
Билет 6.
1. Электролиты и неэлектролиты.
По проводимости электрического тока все вещества делятся на электролиты и неэлектролиты.
Электролиты – это вещества, растворы которых проводят электрический ток. К ним относятся кислоты, основания, соли. Эти вещества проводят ток, т.к. могут диссоциировать на катион и анион:
Кислоты: HAn 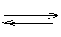 H+ + An-
H+ + An-
Основания: МОН  М+ + ОН-
М+ + ОН-
Соли: МAn→ М++ An-
Индекс после простого иона или скобки становится коэффициентом
Ca3(PO4)2 → 3Ca2+ + 2 (PO4)3-
К неэлектролитам относятся все остальные – простые вещества, оксиды, почти все органические вещества.
2. Общие физические свойства металлов.
Физические свойства металлов определяются их строением: наличием в кристаллической решетки свободных электронов. Благодаря свободным электронам у всех металлов есть электропроводность, теплопроводность и металлический блеск.
Электро-и теплопроводность.Хаотически движущиеся в металле электроны под воздействием приложенного электрического напряжения приобретают направленное движение, в результате чего возникает электрический ток. Наибольшую электропроводность имеют серебро, медь, а также золото, алюминий, железо; наименьшую — марганец, свинец, ртуть.
Чаще всего в той же последовательности, как и электропроводность, изменяется и теплопроводность металлов. Она обусловлена большой подвижностью свободных электронов, которые, сталкиваясь с колеблющимися ионами и атомами, обмениваются с ними энергией. Поэтому происходит быстрое выравнивание температуры по всему куску металла.
Металлический блеск. Электроны, заполняющие межатомное пространство, отражают световые лучи, а не пропускают, как стекло, поэтому все металлы в кристаллическом состоянии имеют металлический блеск.
Остальные свойства – твердость, плотность, плавкость, пластичность – разные.
3. Дать характеристику одного из элементов - металлов (натрия, кальция, алюминия или железа) (все по выбору).
ХАРАКТЕРИСТИКА ЭЛЕМЕНТА-МЕТАЛЛА НА ПРИМЕРЕ алюминия
1. Положение в Периодической системе. Алюминий (порядковый номер13) — это элемент 3 периода, главной подгруппы 3 группы Периодической системы.
2. Строение атома, его свойства. Число протонов в атоме алюминия равно 13, число электронов — 13, число нейтронов в изотопе 2713Аl — 27-13 =14, заряд ядра +13, распределение электронов по уровням 2, 8, 3.
3. Простое вещество. Алюминий— это амфотерный металл. Атомы алюминия проявляют восстановительные свойства.
4. Высший оксид, его характер. Алюминий образует высший оксид, формула которого Al2O3. По свойствам это амфотерный оксид.
4. Высший гидроксид, его характер. Алюминий образует высший гидроксид, формула которого Al(OH)3. По свойствам амфотерное основание.
Билет 7.
1. Понятие о сильных и слабых элекролитах.
К электролитам относятся соли, кислоты, основания.
Соли все сильные электролиты, т.е. хорошо проводят электрический ток. Поэтому в уравнении диссоциации ставят только одну стрелку в сторону распада на ионы
МAn→ М++ An-
Сильные основания – это щёлочи, т.е. растворимые в воде основания.
Са(ОН)2 → Са2++2(ОН)-
Нерастворимые и малорастворимые – слабые, поэтому при написании уравнения диссоциации ставят знак обратимости (помимо ионов, присутствуют молекулы)
МОН  М+ + ОН-
М+ + ОН-
К сильным кислотам относятся HCl, HBr, HI, H2SO4, HNO3, HClO4, HClO3.
2. Сплавы.
— это материалы с характерными свойствами, состоящие из двух или более компонентов, из которых, по крайней мере, один — металл.
В металлургии железо и все его сплавы выделяют в одну группу под названием черные металлы; остальные металлы и их сплавы имеют техническое название цветные металлы.
Подавляющее большинство железных (или черных) сплавов содержит углерод. Их разделяют на чугуны и стали.
Чугун— сплав на основе железа, содержащий более 2 % углерода, а также марганец, кремний, фосфор и серу. Чугун значительно тверже железа, обычно он очень хрупкий, не куется, а при ударе разбивается. Этот сплав применяют для изготовления различных массивных деталей методом литья, так называемый литейный чугун, и для переработки в сталь — передельный чугун.
В зависимости от состояния углерода в сплаве различают серый и белый чугун.
Сталь — сплав на основе железа, содержащий менее 2% углерода. По химическому составу стали разделяют на два основных вида: углеродистая и легированная.
Примерами цветных сплавов могут быть: нихром, припой «третник» , победит , дюралюминий.
Дюралюминий— сплав алюминия (95%), магния, меди и марганца. Очень легкий и прочный сплав. По прочности он равен стали, но в три раза легче ее. Применяют в самолетостроении.
3. Дать характеристику одного из элементов - неметаллов (хлора, серы, фосфора, азота, углерода, кремния) (все по выбору).
ХАРАКТЕРИСТИКА ЭЛЕМЕНТА-НЕМЕТАЛЛА НА ПРИМЕРЕ серы
1. Положение в Периодической системе Сера(порядковый номер16) — это элемент 3 периода, главной подгруппы 6 группы Периодической системы.
2. Строение атома, его свойства. Число протонов в атоме серы равно 16, число электронов — 16, число нейтронов в изотопе 3216S — 32-16 =16, заряд ядра +16, распределение электронов по уровням 2, 8, 6.
3. Простое вещество. Сера — это неметалл. Атомы серы проявляют окислительные свойства.
3.Высший оксид, его характер. Сера образует высший оксид, формула которого SO3. По свойствам это кислотный оксид.
4.Высший гидроксид, его характер. Сера образует высший гидроксид, формула которого H2SO4. По свойствам кислота.
Билет 8.
1. Оксиды: их состав, классификация и названия.
Оксиды– это бинарные соединения, на втором месте у которых стоит кислород со степенью окисления -2.
В зависимости от того, какой элемент стоит на первом месте оксиды делятся на три группы:
1) Основные. Это оксиды, у которых на первом месте стоит металл: СаО, Na2O.
2) Кислотные. Это оксиды, у которых на первом месте стоит неметалл: P2O5.
3) Амфотерные. Это оксиды, у которых на первом мете стоит амфотерный элемент (переходный металл): Аl2O3, Fe2O3
Основным оксидам соответствуют основания. Например, Na2О — NaOH. Кислотным оксидам соответствуют кислоты: P2О5 - H3PО4.
Названия складываются из названия кислорода (по латыни) – оксид, и названия первого элемента с указанием степени окисления (если переменная)
P2+5О5 оксид фосфора (V), Fe2+3O3 оксид железа(III)
2. Подгруппа кислорода: строение и свойства атомов, простых веществ, химические свойства серы.
Ответ см. в билете 1, вопрос 2.
3. Докажите с помощью характерной реакции наличие иона хлорида в хлориде калия.
Cl- + Ag+ (растворимая соль серебра) ® Ag Cl ¯
Белый творожистый осадок
Билет 9.
1. Кислоты. Названия и формулы кислот.
Кислоты – это сложные неорганические вещества, состоящие из катиона водорода и аниона кислотного остатка.
НСl – соляная
HNO3 – азотная
H2SO4 – серная
H2CO3 – угольная
H3PO4 – фосфорная
2. Сплавы.
Ответ см. в билете 7, вопрос 2.
3. Дать характеристику одного из элементов - металлов (лития, магния, калия или алюминия) (все по выбору).
Образец ответа см. в билете 6, вопрос 3.
Билет 10.
1. Положение металлов в периодической системе химических элементов Д.И. Менделеева, строение их атомов и кристаллов.
Ме – это простые вещества, которые легко отдают электроны. Для главных подгрупп:
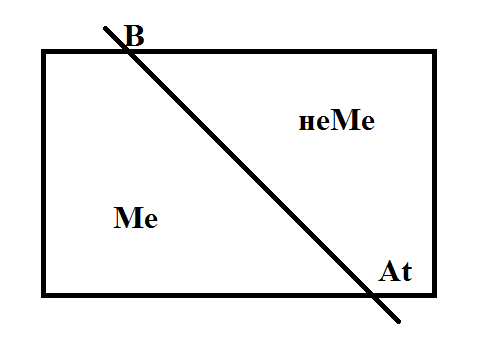
+ к Ме относятся все элементы побочных подгрупп. Такое положение Ме в периодической системе связано с их строением: малое количество электронов на внешнем уровне (1-3), которое у главных подгрупп определяется по № группы, а у побочных – постоянно 2 электрона. Вторая характеристика для Ме – это большой радиус (растет в таблице сверху вниз).
В кристаллической решетке у Ме есть свободные электроны, которые отвечают за главные физические свойства Ме:
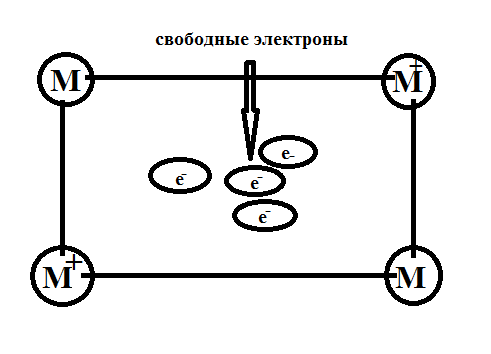
2. Основания в свете ТЭД; их классификация и хим. свойства.
Основания – это электролиты, которые при диссоциации образуют катион металла и анион кислотного остатка.
Классификация:
1. Нерастворимые в воде основания.
2. Щёлочи – растворимые в воде.
Типичные реакции оснований
1. Основание + кислота® соль + вода.
(реакция обмена)
Нl + NaOH = NaCl + Н2O
Н+ + ОН- = Н2O (реакция нейтрализации) .
2.Основание+ кислотный оксид®соль + вода.
(реакция обмена)
2NaOH + N2O5= 2NaNO3+ Н2O
2OН- + N2O5 = 2NO3- + Н2O;
3. Щелочь + соль ® новое основание + новаясоль.
(реакция обмена)
2КOН + CuSO4 = = Cu(OH)2¯+ K2SO4
Cu2+ + 2OH- = = Cu(OH)2¯
4. Нерастворимые в воде основания разлагаются при нагревании на оксид металла и воду, что нехарактерно для щелочей, например:
Сu(ОН)2¯ = СuО + Н2O
3. Расставьте коэффициенты в схемах реакций методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления.
Аl + O2 ® Аl2O3
HNO3 + P® H3PO4 + NO2 + Н2O
При подготовке к экзамену решение см. в лабораторном журнале - практическая работа № 2.
Билет 11.
1. Метод электронного баланса.
Аl0+ O20®Аl2+3O3-2
Выписываем элементы, которые изменили с.о.
Al0 – 3e- → Al+3 4 Al0 – восстановитель, процесс окисления
O20 +2*2e- →2O-2 3 О20 – окислитель, процесс восстановления
Примечание. Если у простого вещества есть индекс (2), то его переносят в электронный баланс.
Уравниваем реакцию с помощью коэффициентов из электронного баланса (4, 3):
4Аl +3O2®2Аl2 O3
2. Общие химические свойства металлов. Электрохимический ряд напряжений металлов и взаимодействие металлов с растворами кислот и солей.
Металлы – восстановители. Восстановительные свойства проявляют в реакциях с простыми и сложными веществами.
I. С простыми – неметаллами
2Na + S = Na2 S сульфид натрия
II. Со сложными: водой, кислотами, растворами солей (реакции замещения). При написании всех этих реакций необходимо учитывать ряд активности (электрохимический ряд) металлов.
