Захист металів від корозії
Пасивність металу створюється утворенням на його поверхні тонкої плівки оксиду. Речовини, які сприяють утворенню такої плівки, як ми вже відзначали, називаються пасиваторами. Світові витрати металу, зв’язаної з корозією складають десятки млн. т врік, тому методам захисту від корозії приділяється належна увага.
Інгібіторний метод
Інгібітори - сповільнювачі корозії, це складні хімічні речовини, які адсорбуються на поверхні металу, захищаючи його від корозії.Інгібіторами можуть служити K2CrO4, K2Cr2O7, NaNO2, Na3PO4, а також високомолекулярні органічні речовини. По мірі експлуатації трубопроводу, збільшується кількість продукту корозії і збільшується опір при перекачуванні продукту. Після перекривання трубопроводу проводять чистку, вводять інгібітор і пізніше пропускають слабий розчин кислоти (рис.13.13).
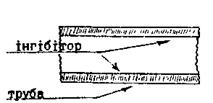
Рисунок 13.13 – Адсорбція інгібітора на внутрішній поверхні трубопровода
Продукти корозії взаємодіють з останньою по схемі:
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
і виводяться з реакційної зони нейтральним розчином.
Захисні покриття
Для захисту від корозії метал покривають іншим металом, більш стійким по відношенню до навколишнього середовища. Захисне покриття повинно бути суцільним і дуже густим. При порушенні цілісності метал, який захищається приходить в контакт з агресивним середовищем, що визиває корозію, тобто утворюється гальванічний елемент. Розрізняють гаряче покриття, метод напилення коли рідкий метал напилюють на інший, гальваностегію і т.д. Всі види покрить розділяють на дві категорії:
Анодне покриття - покриття даного металу більш активним металом, наприклад Fe можна захистити AI, Zn, Cd (рис. 13.14 ):
Катодне покриття– покриття даного мталу менш активним металом, наприклад Fe можна захистити Sn, Pb.
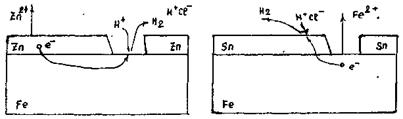
Рисунок 13.14 – Електорхімічні процеси при анодному та катодному захисті
Розглянемо модель, коли деталь працює в стаціонарному режимі, тобто в спокійному стані, без ударів, вібрації. В першому випадку залізо покрите цинком. Цинк - дорогий метал і, очевидно, таке покриття вимагає значних затрат. Якщо ми маємо суцільне покриття, то в стаціонарному, режимі більш вигідно покривати оловом (більш пасивним металом). При порушенні цілостності покривного шару, цинк як більш активний метал, посилає свої йони в розчин. Виникає подвійний електричний шар: Zn0 - 2ē → Zn2+
Якщо ж весь час забирати електрони, тоді цинк руйнується, тобто піддається корозії: 2H+ + 2 ē → H2. Відновлення водню проходить на залізі.
В даному випадку цинк окислюється весь час, не дивлячись на те, що в наявності тріщини. Отже розглянутий випадок анодного покриття, тобто покриття більш активним металом захищає метал навіть у випадку тріщин.
В другому випадку залізо більш активне, посилає свої йони в розчин: Fe0 – 2 ē → Fe2+; 2H+ + 2 ē → H2.
Коли порушується покриття краще щоб олова взагалі не було, процес корозії проходить надзвичайно швидко. Невигідність покриття малоактивним металом очевидна. Якщо ж метал менш активний ніж метал, що захищається, таке покриття носить назву катодного. При пошкодженні катодного покриття метал, який ми захищаємо піддається більшій корозії.
Захисні покриття проводять ще фарбами, емалями, полімерними речовинами, оксидними плівками. Часто проводять процес вороніння, внаслідок чого на поверхні металу утворюються відповідні оксиди (Fe3O4, Cr2O3 та інші).
Протекторний захист
До металу, який необхідно захистити від корозії прикріпляються пластинки більш активного металу – протектора (рис. 13. 15).
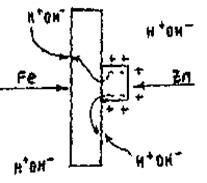
Рисунок 13.15 – Протекторний захист фрагмента залізної конструкції
В гальванічній парі протектором є анод, а конструкція катодом. Протектор поступово руйнується:
2п0 - 2ē → Zn2+; 2H+ + 2 ē → H2 (Fe).
Так захищають металічні конструкції, які знаходяться у водному середовищі.
Катодний захист
Вся поверхня металу, який захищається від корозії штучно робиться катодом (рис.13.16 ):
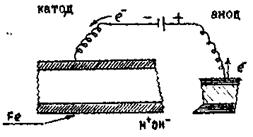
Рисунок 13.16 – Катодний захист фрагмента залізної конструкції
Це досягається приєднанням металу який ми захищаємо до катоду зовнішнього джерела струму. Такий захист від корозії називається катодним. На металі катоду проходить процес: Fe0 – 2 ē → Fe2+ , тобто катод окиснюється, ржавіє, а контрукція буде захищеною. На катоді:
Fe2+ + 2 ē → Fe0, тобто проходить процес відновлення.
Використання вказаного методу вимагає витрат електричної енергії, але цей спосіб піддається легкому контролю по величині струму, значить піддається дистанційному управлінню.
Кожного року внаслідок корозії безповоротно витрачається величезна кількість металу. Світова витрата металу становить приблизно 20 млн. т в рік. Витрати на ремонт або заміну деталей суден, автомобілів, апаратури хімічних виробництв, приладів у багато разів перевищують вартість металу з якого їх виготовляють. Істотними бувають непрямі витрати, спричинені корозією. До них можна віднести витікання нафти або газу з трубопроводів, псування харчових продуктів, втрати здоров’я. Отже, боротьба э корозією є важливою н/г проблемою. На захист від корозії витрачаються значні кошти з метою розвитку робіт по електрохімічних процесах, удосконаленню їх на виробництвах і впровадженню передових теорій в практику.
Питання для самоконтролю
13.1. Що таке електродний потенціал? У чому різниця між електродним і відновним, відновним і окисним потенціалом?
13.2. Чому не можна виміряти абсолютне значення електродного потенціалу?
13.3. Які продукти можна одержати електролізом? Наведіть приклади електролізу з різними типами електродів.
13.4. З якою метою використовують акумулятори та паливні елементи. Наведіть приклади з написанням електрохімічних рівнянь реакцій.
13.5. Зразки сплаву заліза помістили:
1) у дистильовану воду
2) у воду, насичену киснем
3) у воду, насичену сумішшю газів: кисню і карбон (IV) оксиду
4) у воду, через яку пропускали попередньо газоподібний водень.
Корозія сплаву сильніше проходить у випадку ...
13.6. На швидкість корозії металічних конструкцій істотно впливає характер електроліту. Найбільш швидко буде піддаватись корозії металічний виріб, якщо електроліт містить:
1) окисник в кислому середовищі при підвищеній температурі;
2) відновник в кислому середовищі при помірній температурі;
3) окисник у лужному середовищі при низькій температурі;
4) відновник у лужному середовищі при підвищеній температурі.
13.7. Електрохімічна корозія металів, яка наносить велику шкоду, являє собою:
1) руйнування металу при реагуванні його із оксидами нітрогену;
2) реагування металу із киснем повітря;
3) руйнування металу в середовищі електроліту із виникненням всередині системи електричного струму;
4) реагування металу із оксидами сульфуру (IV і VI).
13.8. Корозія металів наносить велику шкоду народному господарству. Тому для боротьби із нею використовують такі основні способи як...
