Методы нефелометрии и турбидиметрии
Количественный анализ, основанный на регистрации параметров рассеяния, осуществляется методами нефелометрии и турбидиметрии. Во многих случаях рассеяние увеличивается с увеличением размеров дисперсных частиц и уменьшением длины волны падающего излучения. Для частиц, диаметр которых соизмерим с λ, интенсивность рассеяния, согласно уравнению Релея, увеличивается обратно пропорционально 4 λ . При увеличении размеров частиц зависимость интенсивности рассеяния от λ ослабляется.
Нефелометрия основана на измерении интенсивности светового потока, рассеянного частицами, находящимися в растворе. При анализе вещество переводят в коллоидное состояние и по степени рассеяния определяют количество коллоидных частиц. Метод нашел применение при анализе белка, лекарственных препаратов, определении мутности воды, при дисперсном анализе порошков. Этот метод используют при анализе молекулярных масс высокомолекулярных соединений (ВМС), формы и размеров дисперсионных систем.
При турбидиметрическом анализе регистрируется световой поток, прошедший через исследуемый раствор, содержащий частицы, и ослабленный вследствие поглощения рассеянными частицами. Коэффициент ослабления пропорционален концентрации взвешенных частиц и в определенном интервале
концентраций подчиняется закону Бугера - Ламберта - Бера. При этом необходимо соблюдать условия получения коллоидных растворов и обеспечения их устойчивости, так как на размеры частиц и оптические свойства получаемых растворов оказывают влияние концентрации смешиваемых растворов, поря-
док и скорость смешения, температура, наличие посторонних примесей и т.д. Взвеси должны иметь малую растворимость и не оседать в процессе анализа. Для увеличения устойчивости взвесей и эмульсий анализ проводят в водно-органической среде при добавлении стабилизирующих добавок.
Основные преимущества оптических
Методов анализа
- сравнительно низкий предел обнаружения % 10 10 6 5 . . K ; в люминесцентном анализе 9 10. %, что особенно важно в анализе сверхчистых веществ;
- избирательность . возможность анализировать смесь компонентов;
- достаточная точность 5 %, иногда % 5 , 0 1K ;
- доступность и простота аппаратуры;
- возможность автоматизации.
8.13 ФОТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
В этом методе конец титрования определяется по резкому изменению оптической плотности исследуемого раствора. Титрование проводят, последовательно измеряя светопоглощение титруемого раствора при определенной длине волны, соответствующей максимуму в спектре поглощения этого вещества, либо титранта, либо прибавленного индикатора.
По результатам измерения строят кривую титрования в координатах А . объем прибавленного титранта. Резкий излом на кривой титрования наблюдается редко, а потому конец титрования находят экстраполяцией линейных участков кривой титрования. Точка пересечения этих кривых отвечает точке эквивалентности.
Фотометрическое титрование - это титрование с измерением А как на фотоколориметрах, так и на спектрофотоколориметрах. Метод обладает селективностью, большей чувствительностью и точностью.
Пример: титрование 4 MnO . ионов раствором 4 FeSO . так называемый безиндикаторный метод.
Титрование поводят при 528 = λ нм . аналитическая волна - 4 MnO .иона и 2400= ελ .
Кривая фотометрического титрования раствора перманганата калия раствором, содержащим Fe2+: А - оптическая плотность раствора, V(Fe2+) . объем прибавленного титранта. Прямые 1 и 2 соответствуют изменению А до и после точки эквивалентности. Крестиками обозначены экспериментальные точки
(рис. 8.5).
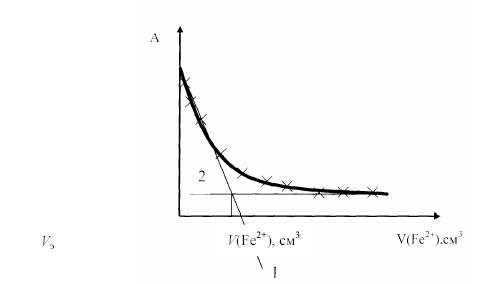
Рис. 8.5 Кривая фотометрического титрования раствора KMnO4
раствором, содержащим Fe2+
Содержательный блок 8: «Оптические методы анализа»
Часть 1
А1УКАЖИТЕ, КАКОЕ ИЗ НИЖЕПЕРЕЧИСЛЕННЫХ ВЫРАЖЕНИЙ ХАРАКТЕРИЗУЕТ СВЯЗЬ МЕЖДУ КОЭФФИЦИЕНТОМ ПРОПУСКАНИЯ (Т, %) И ОПТИЧЕСКОЙ ПЛОТНОСТЬЮ (А):

А2КАКОЙ ФАКТОР НЕ ВЛИЯЕТ НА ВЕЛИЧИНУ МОЛЯРНОГО КОЭФФИЦИЕНТА ПОГЛОЩЕНИЯ?
А3В КАКИХ ЕДИНИЦАХ ВЫРАЖАЕТСЯ МОЛЯРНЫЙ КОЭФФИЦИЕНТ ПОГЛОЩЕНИЯ, ЕСЛИ КОНЦЕНТРАЦИЯ ВЫРАЖЕНА В МКГ/СМ3?

А4УКАЖИТЕ, В КАКИХ СЛУЧАЯХ СОХРАНЯЕТСЯ ЛИНЕЙНАЯ ЗАВИСИМОСТЬ ОПТИЧЕСКОЙ ПЛОТНОСТИ ОТ КОНЦЕНТРАЦИИ:

А5СООТНЕСИТЕ УЗЛЫ ПРИБОРОВ, ПРИМЕНЯЕМЫХ ДЛЯ АНАЛИЗА ПО СВЕТОПОГЛОЩЕНИЮ, ИХ НАЗНАЧЕНИЮ:


А6ИНФРАКРАСНАЯ СПЕКТРОСКОПИЯ ИЗУЧАЕТ УЧАСТОК ЭЛЕКТРОМАГНИТНОГО СПЕКТРА В ИНТЕРВАЛЕ:

А7УКАЖИТЕ, НА ЧЁМ ОСНОВАН НЕФЕЛОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА:

А8КАКОЕ ТИТРОВАНИЕ НЕОБХОДИМО ИСПОЛЬЗОВАТЬ, КОГДА НИ ОДИН ИЗ КОМПОНЕНТОВ НЕ ПОГЛОЩАЕТ СВЕТ В ДОСТУПНОЙ ОБЛАСТИ СПЕКТРА?
А9КАК ВЫГЛЯДИТ КРИВАЯ СПЕКТРОФОТОМЕТРИЧЕСКОГО ТИТРОВАНИЯ, ЕСЛИ СВЕТОПОГЛОЩЕНИЕ ОСУЩЕСТВЛЯЕТСЯ ПРОДУКТОМ РЕАКЦИИ (ИССЛЕДУЕМОЕ ВЕЩЕСТВО И РЕАГЕНТ НЕ ПОГЛОЩАЮТ СВЕТ)?
А10СОДЕРЖАНИЕ, КАКИХ ИОНОВ МЕШАЕТ ФОТОМЕТРИЧЕСКОМУ ОПРЕДЕЛЕНИЮ МОЛИБДЕНА(VI) В ФОРМЕ РОДАНИДА МОЛИБДЕНА, ЕСЛИ В КАЧЕСТВЕ ВОССТАНОВИТЕЛЯ ИСПОЛЬЗУЕТСЯ SNCL2 , А ДЛЯ СОЗДАНИЯ КИСЛОТНОСТИ ДОБАВЛЯЕТСЯ 5 % НСL?

ЧАСТЬ 2
В1ОПТИЧЕСКАЯ ПЛОТНОСТЬ РАСТВОРА ПРИ НЕКОТОРОЙ ДЛИНЕ ВОЛНЫ РАВНА 0,562. РАССЧИТАЙТЕ ПРОПУСКАНИЕ Т ТОГО ЖЕ РАСТВОРА, %.

В2РАССЧИТАЙТЕ СРЕДНИЙ МОЛЯРНЫЙ КОЭФФИЦИЕНТ ПОГЛОЩЕНИЯ
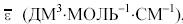 , ДЛЯ КИСЛЫХ И ВОДНЫХ РАСТВОРОВ
, ДЛЯ КИСЛЫХ И ВОДНЫХ РАСТВОРОВ 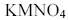 ПРИ
ПРИ 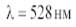 ПО СЛЕДУЮЩИМ ЗНАЧЕНИЯМ МОЛЯРНОЙ КОНЦЕНТРАЦИИ С И ОПТИЧЕСКОЙ ПЛОТНОСТИ А РАСТВОРОВ (L = 1 СМ).
ПО СЛЕДУЮЩИМ ЗНАЧЕНИЯМ МОЛЯРНОЙ КОНЦЕНТРАЦИИ С И ОПТИЧЕСКОЙ ПЛОТНОСТИ А РАСТВОРОВ (L = 1 СМ).
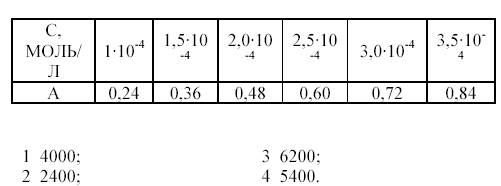
В3МОЛЯРНЫЙ КОЭФФИЦИЕНТ ПОГЛОЩЕНИЯ KМNO4 ПРИ λ = 546 НМ РАВЕН 2420. ОПТИЧЕСКАЯ ПЛОТНОСТЬ ИССЛЕДУЕМОГО РАСТВОРА В КЮВЕТЕ ТОЛЩИНОЙ СЛОЯ 2 СМ РАВНА 0,80. ЧЕМУ РАВЕН Т(KМNO4/МN), Г/СМ3?

В4ИОНЫ ЖЕЛЕЗА FE3+ БЫЛИ ОБНАРУЖЕНЫ В РАСТВОРЕ С РОДАНИДОМ АММОНИЯ NH4SCN В КОЛОРИМЕТРЕ ПОГРУЖЕНИЯ. ОДИНАКОВАЯ ИНТЕНСИВНОСТЬ ОКРАСКИ ДОСТИГНУТА ПРИ ВЫСОТЕ СЛОЯ АНАЛИЗИРУЕМОГО РАСТВОРА 27,9 ММ И СТАНДАРТА 30,3 ММ. ВЫЧИСЛИТЕ СОДЕРЖАНИЕ ИОНОВ FE3+ В РАСТВОРЕ, ЕСЛИ СТАНДАРТНЫЙ РАСТВОР СОДЕРЖИТ 100 МГ/ДМ3 ЖЕЛЕЗА.

В5РАССЧИТАЙТЕ МИНИМАЛЬНУЮ ОПРЕДЕЛЯЕМУЮ МАССУ (МГ) ЖЕЛЕЗА(III) ПО РЕАКЦИИ С СУЛЬФОСАЛИЦИЛОВОЙ КИСЛОТОЙ В АММИАЧНОЙ СРЕДЕ ПРИ ИСПОЛЬЗОВАНИИ КЮВЕТЫ С ТОЛЩИНОЙ СЛОЯ L = 5 СМ; ОБЪЕМ ОКРАШЕННОГО РАСТВОРА V = 5 СМ3; МОЛЯРНЫЙ КОЭФФИЦИЕНТ ПОГЛОЩЕНИЯ РАВЕН 4000; МИНИМАЛЬНАЯ ОПТИЧЕСКАЯ
ПЛОТНОСТЬ, ИЗМЕРЯЕМАЯ ПРИБОРОМ, СОСТАВЛЯЕТ 0,01.

В6МОЛЯРНЫЙ КОЭФФИЦИЕНТ ПОГЛОЩЕНИЯ ЛЕКАРСТВЕННОГО ПРЕПАРАТА РЕТИНОЛА АЦЕТАТА (С22Н32О2) В СПИРТОВОМ РАСТВОРЕ РАВЕН ε = 50900 ПРИ λ = 326 НМ. РАССЧИТАЙТЕ ОПТИМАЛЬНУЮ КОНЦЕНТРАЦИЮ В Г/ДМ3 РЕТИНОЛА АЦЕТАТА В СПИРТОВОМ РАСТВОРЕ. ЕСЛИ L = 1 СМ.

В7ДЛЯ ОПРЕДЕЛЕНИЯ НИКЕЛЯ В КАТАЛИЗАТОРЕ ГИДРИРОВАНИЯ ЖИРОВ НАВЕСКУ
КАТАЛИЗАТОРА, РАВНУЮ 0,2150 Г, РАСТВОРИЛИ, ДОВЕЛИ ДО МЕТКИ В МЕРНОЙ КОЛБЕ ВМЕСТИМОСТЬЮ 200 СМ3. К 10 СМ3 ЭТОГО РАСТВОРА ДОБАВИЛИ ТАРТРАТА КАЛИЯ-НАТРИЯ, АММИАК, ПЕРСУЛЬФАТ АММОНИЯ, ДИМЕТИЛГЛИОКСИМ, ПОДОГРЕЛИ В ТЕЧЕНИЕ 5 МИН, ОХЛАДИЛИ. ПО ГРАДУИРОВОЧНОМУ ГРАФИКУ ОПРЕДЕЛИЛИ, ЧТО В АНАЛИЗИРУЕМОМ РАСТВОРЕ СОДЕРЖИТСЯ 2,1 МГ НИКЕЛЯ. ОПРЕДЕЛИТЕ МАССОВУЮ ДОЛЮ НИКЕЛЯ В КАТАЛИЗАТОРЕ.

В8НАВЕСКУ СТАЛИ 0,2500 Г РАСТВОРИЛИ В СМЕСИ КИСЛОТ. РАСТВОР РАЗБАВИЛИ В МЕРНОЙ КОЛБЕ ВМЕСТИМОСТЬЮ 100 СМ3. К 25 СМ3 ПОЛУЧЕННОГО РАСТВОРА ДОБАВИЛИ ЛЯ ОПРЕДЕЛЕНИЯ ТИТАНА ПЕРОКСИД ВОДОРОДА, ФОСФОРНУЮ КИСЛОТУ, РАЗБАВИЛИ ДО 50 СМ3. ОПТИЧЕСКАЯ ПЛОТНОСТЬ ПОЛУЧЕННОГО ЖЁЛТОГО РАСТВОРА РАВНА 0,220. К ДРУГОЙ ПОРЦИИ 25 СМ3 ДОБАВИЛИ РАСТВОР, СОДЕРЖАЩИЙ 0,200 МГ ТИТАНА И ОБРАБОТАЛИ АНАЛОГИЧНО ПЕРВОМУ РАСТВОРУ. ОПТИЧЕСКАЯ ПЛОТНОСТЬ ЭТОГО РАСТВОРА ОКАЗАЛАСЬ РАВНОЙ 0,500. ЧЕМУ РАВНА МАССОВАЯ ДОЛЯ ТИТАНА В СТАЛИ?

В9ВЫЧИСЛИТЕ МОЛЯРНЫЙ КОЭФФИЦИЕНТ ПОГЛОЩЕНИЯ КОМПЛЕКСА МЕДИ, ЕСЛИ ОПТИЧЕСКАЯ ПЛОТНОСТЬ РАСТВОРА, СОДЕРЖАЩЕГО 0,40 МГ МЕДИ В 250 СМ3 ПРИ L = 1СМ РАВНА 0,150.

В10МОЛЯРНЫЙ КОЭФФИЦИЕНТ ПОГЛОЩЕНИЯ СВИНЦА С ДИТИЗОНОМ ПРИ λ = 485 НМ РАВЕН 6,8・104. ЧЕМУ РАВНА ОПТИЧЕСКАЯ ПЛОТНОСТЬ РАСТВОРА, СОДЕРЖАЩЕГО 3 МКГ PBO2 В 5 СМ3 ПРИ ИЗМЕРЕНИИ В 1-САНТИМЕТРОВОЙ КЮВЕТЕ?

ЧАСТЬ 3
С1ДЛЯ ПРИГОТОВЛЕНИЯ СТАНДАРТНОГО РАСТВОРА СОЛИ CU2+ 1,7080 Г CUSO4・5H2O РАСТВОРИЛИ В 1000 СМ3 ВОДЫ. ИЗ НЕГО ПРИ ДОБАВЛЕНИИ АММИАКА ПОЛУЧИЛИ 10 ОКРАШЕННЫХ РАСТВОРОВ, СОДЕРЖАЩИХ ОТ 1,00 ДО 10,00 СМ3 СТАНДАРТНОГО РАСТВОРА В 20,00 СМ3 ВОДЫ. ЗАТЕМ 0,7500 Г ИССЛЕДУЕМОГО ВЕЩЕСТВА РАСТВОРИЛИ В 250 СМ3 ВОДЫ. ПОСЛЕ ВЗАИМОДЕЙСТВИЯ 10,00 СМ3 ЭТОГО РАСТВОРА С АММИАКОМ И РАЗБАВЛЕНИЯ ДО 20,00 СМ3 ИНТЕНСИВНОСТЬ ОКРАСКИ ЕГО ОКАЗАЛАСЬ РАВНОЙ ИНТЕНСИВНОСТИ ОКРАСКИ ВОСЬМОГО СТАНДАРТНОГО РАСТВОРА. ВЫЧИСЛИТЕ МАССОВУЮ ДОЛЮ (%) МЕДИ В ИССЛЕДУЕМОМ ВЕЩЕСТВЕ.



С2АНАЛИЗИРУЕМЫЙ РАСТВОР ОБЪЁМОМ 100 СМ3 СОДЕРЖИТ ПЕРМАНГАНАТ-ИОНЫ 4 MnO И ДИХРОМАТ-ИОНЫ . 2
7 2O Cr . ОПРЕДЕЛИТЕ МАССУ МАРГАНЦА И ХРОМА В АНАЛИЗИ-
РУЕМОМ РАСТВОРЕ, ЕСЛИ ОПТИЧЕСКАЯ ПЛОТНОСТЬ АНАЛИЗИРУЕМОГО РАСТВОРА СО СВЕТОФИЛЬТРАМИ, 364 И 540 НМ, РАВНА А364 = = 0,470 И А540 = 0,280 СООТВЕТСТВЕННО В КЮВЕТЕ С L = 1 СМ. ПРЕДВАРИТЕЛЬНО УСТАНОВЛЕНО, ЧТО ОСНОВНОЙ ЗАКОН СВЕТОПОГЛОЩЕНИЯ ДЛЯ ИССЛЕДУЕМЫХ РАСТВОРОВ ВЫПОЛНЯЕТСЯ В ПРЕДЕЛАХ КОНЦЕНТРА-
ЦИЙ 0,5・10-4 - 2,5・10-4 МОЛЬ/ДМ3 ДЛЯ КАЖДОГО ИОНА В ОТДЕЛЬНОСТИ. СРЕДНИЕ МОЛЯРНЫЕ КОЭФФИЦИЕНТЫ ПОГЛОЩЕНИЯ НАЙДЕНЫ РАВНЫМИ:


ХРОМАТОГРАФИЯ
9.1 ОБЩАЯ ХАРАКТЕРИСТИКА
Хроматография – методы разделения и анализа смеси веществ, основанные на различной сорбции компонентов анализируемой смеси (подвижной фазы) определенным сорбентом (неподвижной фазой). В зависимости от строения разделяемые компоненты в различной степени удерживаются той или
другой фазами, поэтому они могут быть отделены друг от друга.
Хроматографические методы занимают видное место для разделения, анализа и исследования свойств химических соединений. Отличительной особенностью хроматографических методов анализа являются: высокая эффективность, простота эксперимента, селективность, экспрессность, возможность автоматизации в сочетании с другими физико-химическими методами. Особая ценность этих методов заключается в том, что с помощью хроматографии возможно разделение соединений с близкими свойствами.
В 1903 г. русский ботаник Цвет М.С. опубликовал работу ≪О новой категории адсорбционных явлений и о применении их к биохимическому анализу≫, положившей начало хроматографии.
Сущность метода по Цвету:
≪При фильтрации смешанного раствора через слой адсорбента пигменты... рассматриваются в виде отдельных различно окрашенных зон. Подобно световым лучам в спектре различные компоненты сложного пигмента закономерно распределяются друг за другом в столбе адсорбента и становятся доступны качественному определению. Такой расцвеченный препарат я называю хроматограммой, а соответствующий метод анализа хроматографическим...≫
Так как Цвет пропускал исследуемый раствор через столб адсорбента, находящегося в стеклянной трубке, этот метод был назван колоночной хроматографией.
В 1938 г. Измайлов Н.А. с сотрудниками предложил проводить разделение смеси веществ на пластинке, покрытой тонким слоем адсорбента . тонкослойная хроматография, позволяющая проводить микроанализ биологических веществ. Она основана на различии скоростей перемещения компонентов анализируемой пробы в плоском тонком слое сорбента при движении по нему растворителя (элюента) под действием капиллярных или гравитационных сил. Разделение в этом методе осуществляется посредством многократного пересечения молекулами вещества границы фаз, т.е. вследствие многократного повторения акта распределения вещества между ПФ и НФ. ПФ . подвижная фаза, НФ . неподвижная фаза (сорбент). Ее разновидность . бумажная хроматография.
Распределительная хроматография (1945 г.) основана на различии в распределении компонентов пробы между двумя компонентами системы, содержащей не смешиваемые жидкие фазы - подвижную фазу и неподвижную, которая нанесена на твердый носитель. Компоненты смеси распределяются между жидкими фазами в соответствии с их сродством к этим фазам.
В настоящее время одним из важнейших направлений хроматографии является ионообменная, которая была предложена в 1947 г. Она основана на различной способности разделяемых ионов к ионному обмену с ионитом . специальным веществом, которое вводится в НФ, превращая ее тем самым в
ионообменник.
Любые варианты хроматографии, как бы они внешне не отличались друг от друга, имеют общий принцип: распределение компонентов смеси между двумя фазами, одна из которых неподвижна и имеет развитую поверхность (НФ), а другая (ПФ) . поток, фильтрующийся через неподвижный слой.
9.2 СОРБЦИОННЫЕ ПРОЦЕССЫ
Сорбцией (sorbeo . лат.. поглощаю, втягиваю) называется поглощение газов, паров растворенных веществ твердыми и жидкими поглотителями. (Повседневная практика . крашение материала).
Десорбция . отдача сорбированного вещества (обесцвечивание вещества при стирке).
Адсорбция . поглощение растворенных или газообразных веществ на поверхности твердого или жидкого тела. Поверхность сорбента очень велика (1 г угля в противогазе имеет поверхность 600 . 1000 м2).
Абсорбция . поглощение веществ во всем объеме твердой или жидкой фазы (черновая Pt, пористый Pd). При этом один объем твердого металла (Pd) поглощает до 400 объемов водорода, который при нагревании снова может быть получен в чистом виде. Газ . жидкость . растворение воздуха (О2) в воде.
Абсорбция широко применяется в химической технологии.
9.3 УРАВНЕНИЕ ЛЕНГМЮРА
Фактическое количество адсорбированного вещества (газа) твердым телом является сложной функцией различных параметров, таких как площадь твердой поверхности, число активных центров на единицу площади, прочность связи вещества с твердой поверхностью, температура и т.д.; поэтому количество адсорбированного вещества (х) на один грамм твердого адсорбента (m) характеризующих адсорбцию (х/m = a) .Эту величину обычно относят к концентрации вещества при помощи эмпирических соотношений, таких как изотерма Ленгмюра. Изотермы адсорбции . это графическая зависимость адсорб-
ции от концентрации при постоянной температуре (уравнение Ленгмюра). Теоретически легче описать адсорбцию паров на твердой поверхности.

То есть при малых концентрациях адсорбция прямо пропорциональна концентрации; при больших концентрациях . она является постоянной величиной, так как происходит насыщение поверхности адсорбента.
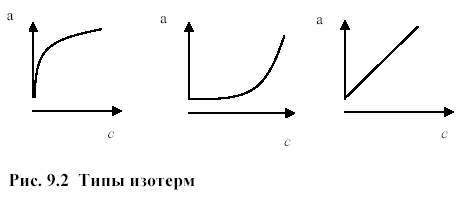
На практике встречаются три типа изотерм адсорбции: выпуклая, вогнутая и линейная (рис. 9.2).
Распределение растворенного вещества между фазами должно линейно меняться с изменением концентрации, т.е. изотерма адсорбции должна быть линейна. При несоблюдении этого условия (пропорциональности от концентрации) изотермы изображаются кривой.
Каждому адсорбенту присуща своя изотерма, т.е. она является основной характеристикой адсорбционной способности поглотителя. На рис. (9.3) представлены изотермы сорбентов А и Б, а на рис. (9.4) представлена температурная зависимость адсорбции.
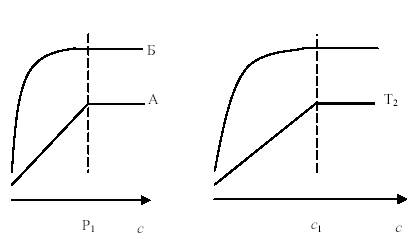

Сорбент А хуже Б, так как при одинаковом давлении он адсорбирует в 2 раза меньше газа.
Адсорбция уменьшается с повышением температуры и, наоборот. Сравним изотермы для одной системы газ . сорбент, но при различной температуре, Т2 > Т1. Количество поглощенного газа резко уменьшается с повышением температуры.
При поглощении молекул из жидких сред процесс адсорбции усложняется, так как растворитель удерживается на поверхности адсорбента, уменьшает его адсорбируемость и искажает тип изотерм. Поэтому в таких случаях выбирают растворитель с наименьшей сорбционной способностью по отношению к сорбенту.
9.4 Классификация хроматографических методов
Под действием диффузии и других физико-химических факторов молекулы разделяемых веществ пересекают поверхность раздела обеих фаз. Этот процесс можно охарактеризовать как элементарный акт взаимодействия анализируемого вещества (сорбата) с неподвижной фазой (сорбентом). Данный акт осуществляется многократно, причем каждый раз достигается некоторый эффект разделения. Чем эффективнее такой элементарный акт и чем чаще он повторяется, тем выше эффект разделения. При продвижении компонентов исследуемой смеси в разделяющей среде такой процесс межфазового перехода
можно описать как многократное повторение актов сорбции и десорбции. По завершении этого процесса компоненты удерживаются той или иной фазой в зависимости от своих свойств, т.е. чем больше сродство компонента к НФ, тем сильнее он сорбируется, тем медленнее он продвигается с ПФ. Так как
компоненты смеси обладают разным сродством к сорбенту, то при перемещении смеси вдоль сорбента произойдет разделение: одни компоненты задержатся в начале пути, другие продвинутся дальше и т.д.
В основе классификации хроматографии следующие критерии:
- агрегатное состояние фаз;
- природа элементарного (единичного) акта взаимодействия, т.е. механизм разделения;
- аппаратурное оформление процесса;
- способ относительного перемещения фаз;
- конечная цель процесса.
Рассмотрим каждый из перечисленных вариантов более подробно.
1 Агрегатное состояние фаз. Обычно, данный критерий является основным, так как природа элементарных актов сорбции-десорбции на твердой и жидкой фазах принципиально различна. В зависимости от агрегатного состояния подвижной фазы (ПФ) различают жидкостную (ЖХ) и газовую хроматографию (ГХ).
В ЖХ роль неподвижной фазы (НФ) обычно играет сорбент, а в качестве ПФ используется растворитель (элюент). В этом случае процесс разделения в значительной степени определяется составом ПФ, в качестве которой используются различные вещества, при этом для каждого случая необходимо подбирать подходящую систему разделения.
В ГХ в качестве носителя пробы . ПФ . выступает газ, а в основе . процессы распределения между фазами и процессы адсорбции, поэтому ГХ делится на адсорбционную (НФ . твердое вещество) и жидкостную (НФ . жидкость). Свойства газа-носителя имеют второстепенное значение для процесса разделения, так как он служит только для перемещения разделяемой смеси.
2 Природа элементарного (единичного) акта взаимодействия. Известно несколько вариантов единичного акта взаимодействия исследуемой среды с веществами НФ и ПФ.
А Адсорбция разделяемых веществ на поверхности сорбента. Она различна и является основой адсорбционной хроматографии.
Б Различия в растворимости веществ. Этот вариант реализуется при использовании жидкой НФ. Элементарный акт взаимодействия, при этом, как правило, является актом растворения компонентов пробы в растворителе (жидкая фаза) и разделении их между ПФ и НФ в соответствии с коэффициентами распределения.
В Водородная связь или химическое сродство компонентов вещества пробы с материалом НФ. Разделение при этом происходит за счет химического взаимодействия с образованием мало растворимого осадка (хемосорбционная, или осадочная хроматография).
3 Аппаратурное оформление (техника выполнения).
По способу размещения НФ различают колоночную (наиболее распространенную) и плоскостную (на бумаге или тонком слое сорбента) хроматографию.
Способ размещения НФ в значительной степени определяет конструкцию хроматографа . прибора, в котором протекает процесс разделения пробы. Результатом выполнения исследования является хроматограмма - графическая запись, отражающая информацию о выделенных компонентах (чаще всего - в
виде пиков, амплитуда которых пропорциональна количественному соотношению компонентов).
Метод колоночной жидкостной хроматографии впервые был предложен в 1906 г. как метод разделения смеси веществ. Неподвижную фазу помещают в колонку, затем вносят в нее анализируемую смесь (пробу) и элюируют соответствующим растворителем (ПФ). При продвижении по колонке компоненты смеси по-разному удерживаются сорбентом в зависимости от их физико-химических свойств
и, следовательно, перемещаются с разной скоростью. На выходе колонки разделяемые вещества появляются в определенной последовательности и могут быть собраны в виде отдельных фракций.
Колоночная газовая хроматография является методом разделения летучих веществ: газов (при нормальной температуре) или паров (при повышенной температуре). В качестве НФ используются твердые материалы (насадочные или набивные колонки); твердые материалы, покрытые слоем жидкости, или же
капилляры с нанесенным на внутреннюю поверхность слоем жидкости (капиллярные колонки). В качестве ПФ используют газ-носитель, переносящий разделяемые вещества через колонку. Разделение анализируемой смеси осуществляется за счет различного времени удерживания компонентов пробы в неподвижной фазе.
Основные группы органических веществ, которые могут быть определены этим методом: газы, летучие жидкие соединения, жидкие аэрозоли. Жидкостная и газовая хроматография отличаются свойствами ПФ . в газовой хроматографии газ-носитель обладает высокой скоростью диффузии и способностью сжиматься.
4 Способ относительного перемещения фаз. В зависимости от характера перемещения сорбирующихся веществ вдоль слоя сорбента различают проявителъный (элюентный), фронтальный и вытеснительный варианты хроматографического процесса.
Их схематические изображения и хроматограммы представлены на рис. (9.5). По оси ординат на графиках отложено свойство выходного потока, зависящее от его состава (например, концентрация компонента), по оси абсцисс . время разделения.
4.1 Проявительный (элюентный) метод. Этот метод нашел широкое применение. В верхний слой колонки вводят небольшое количество анализируемой смеси и промывают колонку чистым растворителем (элюентом) или газом, а в отдельных случаях раствором веществ (обычно комплексообразующих), дифференцирующих сорбционные свойства анализируемой смеси. По мере прохождения элюента через колонку вещества перемещаются с ним с различной скоростью, зависящей от сродства к сорбенту. При многократном промывании достигается четкое отделение компонентов друг от друга.
В качестве примера рассмотрим разделение меди(II) и железа(III) методом ионообменной хроматографии с последующим титриметрическим определением меди и фотометрическим определением железа. Медь (II) и железо (III) ,совместно присутствующие в водном растворе, можно разделить на катионообменнике (например, на катионите КУ-2). Предварительно катионит, которым заполнена хроматографическая колонка, переводят в Н-форму.
Для разделения меди(II) и железа(III) их переводят в комплексные соединения с противоположными знаками зарядов, прибавляя в анализируемую смесь растворы сульфосалициловой кислоты
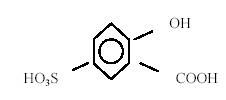
и аммиака. В этих условиях медь(II) образует положительно заряженный комплекс [Cu(NH3)4]2+, а железо(III) . отрицательно заряженный сульфосалициловый комплекс, состав и заряд которого зависят от концентрации прибавленной сульфосалициловой кислоты и рН среды.
Обычно считается, что в условиях проведения анализа образуется трисульфосалицилатный анионный комплекс железа(III) желтого цвета.
При пропускании полученного раствора через колонку с катионитом в Н-форме катионы [Cu(NH3)4]2+ сорбируются на катионите, а отрицательно заряженные сульфосалицилатные комплексы железа(III) на катионите не сорбируются и уносятся с ПФ, которую собирают в мерной колбе.
После этого через колонку несколько раз пропускают смесь растворов сульфосалициловой кислоты и аммиака, собирают элюат в ту же мерную колбу, которую затем доводят до метки дистиллированной водой, и получают раствор желтого цвета, содержащий все исходное железо(III).
Медь(II) затем элюируют из колонки раствором HCI, собирая элюат в другую мерную колбу. Для этого через колонку с катионитом, содержащим медь(II), пропускают 4 М раствор HCI, после чего колонку несколько раз промывают дистиллированной водой до отрицательной реакции на Cu(II) . ион, при этом аммиачный комплекс меди(II) разрушается и медь(II) элюируется уже в форме хлоридных комплексов. Элюат и промывные воды, собранные в мерной колбе, доводят дистиллированной водой до метки и получают раствор, содержащий всю отделенную медь(II). Содержание меди(II) в растворе определяют йодометрическим титрованием, а Fe(III) фотоколориметрическим методом.
4.2 Фронтальный метод. Заполненную колонку промывают растворителем (жидкость или газ), в котором содержатся исследуемые компоненты А, В и С, обладающих различной сорбируемостью, которая повышается от А к С. Пробу (она же ПФ) пропускают через слой сорбента. Вместе с растворителем
вначале из колонки выходят порции наименее сорбирующегося вещества А, потом смесь А(примесь)+В и наконец смесь всех веществ. Число ступенек на хроматограмме равно количеству компонентов смеси. Метод позволяет выделить только одно вещество . А, а В и С . содержат примеси.
4.3 Вытеснительный метод. Он основан на том, что десорбцию компонентов пробы осуществляют потоком раствора, содержащего специальное вещество . вытеснитель, которое сорбируется лучше любого из разделяемых компонентов. Заполненную сорбентом колонку предварительно промывают ПФ и вводят в нее порцию пробы. Затем через колонку пропускают поток ПФ, содержащий вытеснитель, который последовательно вытесняет из НФ компоненты в порядке убывания их сорбционной способности: самый сильно сорбирующийся компонент вытесняет менее сорбирующийся, тот . следующий и т. д.
Таким образом, компоненты пробы перемещаются вдоль колонки впереди фронта зоны вытеснителя в порядке увеличения их сорбционных свойств. На хроматограмме также получается ступенчатая кривая, но каждая ступенька соответствует только одному компоненту. В результате каждый компонент не отделяется зоной чистого растворителя (зоны частично перекрываются).
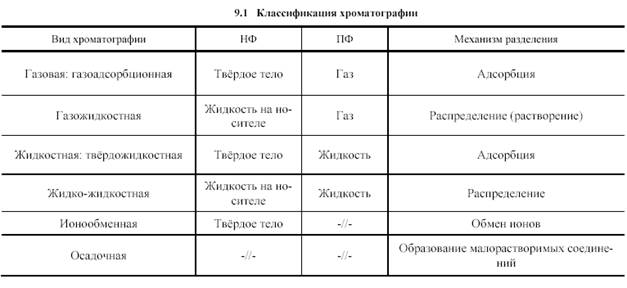
Все отмеченные критерии классификации методов хроматографии являются независимыми, поэтому при обозначении конкретного метода они должны быть оговорены отдельно. Однако на практике используют более простую систему классификации, в основе которой . учет только агрегатного состояния фаз и природы элементарного взаимодействия (табл. 9.1). При необходимости обозначение конкретного метода дополняется описанием способов аппаратурного оформления процесса и относительного перемещения фаз. Отдельно может оговариваться назначение метода.

5 Конечная цель процесса. Хроматографию можно рассматривать как гибридный метод, в котором технологический процесс представляет собой часть аналитической системы, сочетающей разделение и измерение. В связи с этим сам хроматографический процесс может использоваться либо в технологических задачах, связанных с получением материальных продуктов (препаративное применение), либо для получения информации о качественном и количественном составе и физико-химических свойствах исследуемых объектов (аналитическое применение). В последнем случае хроматография может применяться в сочетании с другими физико-химическими методами.
9.5 ГАЗОЖИДКОСТНАЯ ХРОМАТОГРАФИЯ
Этот метод является наиболее удобным и практически важным хроматографическим методом. В этом методе используются приборы такого же типа, как и в газо-адсорбционной хроматографии (рис. 9.6). Установки отличаются только твердыми носителями.
В качестве НФ используют многие жидкости. Эффективное разделение зависит от правильного выбора НФ, который определяется температурой, которую необходимо создать в колонке, и природой разделяемых веществ.
Неподвижная жидкая фаза должна:
- обладать очень низким давлением пара при рабочей температуре; в противном случае количество жидкой фазы на носителе будет постепенно уменьшаться;
- оставаться в жидком состоянии во всем диапазоне температур, в котором работает колонка;
- быть термически стойкой;
- быть инертной по отношению к растворенным в ней веществам;
- обладать достаточной растворяющей способностью к определяемым компонентам газовой смеси.
Регистрирующее устройство хроматографа позволяет получить три характеристики :время удерживания, размер пика и его форму, по которым судят о качественном и количественном составе смеси.
9.6 ПАРАМЕТРЫ ХРОМАТОГРАММЫ
Характеристики хроматограммы зависят от двух основных факторов: природы сорбента и состава ПФ. После разделения смеси идентификацию компонентов проводят с помощью того или иного метода анализа. Подобный анализ весьма трудоемок и при массовых определениях компоненты идентифицируют по их хроматографическому поведению. Для этого сравнивают хроматограммы исследуемой смеси и стандартного вещества. Одинаковое значение удерживаемого объема анализируемого и стандартного компонента свидетельствует об их одинаковой химической природе.
На рис. 9.7 представлена типичная изотермическая хроматограмма. Рассмотрим ее основные параметры.
Сорбционная способность НФ по отношению к разделяемым веществам характеризуется временем удерживания tR Это - промежуток времени от момента введения вещества в слой сорбента до момента появления элюентного пика tR1 и tR2; tR0 . ≪мертвое время≫ колонки.
На практике часто измеряют не время удерживания, а расстояние удерживания l, пропорциональное времени удерживания, т.е. расстояние (например, в мм) на хроматограмме от точки, соответствующей моменту ввода пробы, до абсциссы, отвечающей положению максимума (вершины) пика.
Кроме времени удерживания иногда используют параметр VR . объем удерживания (удерживаемый объем) . это объем подвижной фазы, прошедший при этом через слой сорбента; он пропорционален времени удерживания tR и скорости потока v.

где VR . объем удерживания, см3; v . скорость потока, см3/мин; tR . время удерживания, мин.
Высота выходной кривой (пика) h . это перпендикуляр, опущенный из максимума пика на нулевую линию. Нулевая линия - часть хроматограммы, полученная при регистрации сигнала детектора во время выхода из колонки чистой ПФ. Ширина пика μ - отрезок, отсекаемый на нулевой линии касательными к кривой в точках перегиба, или расстояние между точками контура пика на середине высоты.
Параметры удерживания какого либо соединения в смеси при определенных условиях характеризуют природу этого соединения и могут быть использованы для целей идентификации.
9.7 Расчет содержания определяемого
вещества
На практике применяют преимущественно следующие методы расчета содержания определяемых компонентов в хроматографируемых смесях: абсолютной градуировки (калибровки), внутренней нормализации и внутреннего стандарта. Все методы основаны на измерении параметров пиков на хроматограмме, а именно: их площади или высоты. Чаще всего измеряют площади пиков.
Площадь каждого пика на хроматограмме рассчитывают вручную при условии, что сигнал детектора должен быть пропорционален концентрации вещества, а пик - симметричен. Существуют различные способы определения площади пика:
- расчет площади пика осуществляют как произведение его высоты на полуширину. При идеальной форме пика (гауссова кривая) таким путем учитывается 94 % фактической площади. Однако данным способом нельзя определять площадь низких пиков с большим основанием, а при оценке асимметричных пиков возникают большие ошибки:
- способ электронного интегрирования (методы планиметрии). Этот метод имеет целый ряд преимуществ, в частности, удобен при анализе сложного профиля элюирования (серийные анализы), исключает субъективную оценку и позволяет не проводить коррекцию базовой линии. Он позволяет автоматизировать последующие операции: определение начала пика; окончания пика: положения максимума, площади пика; коррекцию базовой линии (дрейф); получение сведений о положении пика на профиле элюирования.
Для всех способов расчета необходимо вводить поправочные коэффициенты, специфические для каждой группы веществ, которые приводятся в специальных таблицах.
