Химические свойства алкенов
1. Окисление алкенов.
1.1 Горение.
В избытке воздуха или кислорода все алкены сгорают до углекислого газа и воды:
СН3 – СН = СН2 + 4,5 О2  3 СО2 + 3 Н2О
3 СО2 + 3 Н2О
Горение алкенов не применяется в двигателях внутреннего сгорания, так как при хранении бензина они осмоляются и смолы забивают топливную аппаратуру (инжектор).
Возможность горения алкенов следует учитывать при транспортировке и хранении на химических предприятиях.
1.2 Окисление алкенов расчётным количеством кислорода воздуха в присутствии серебра.
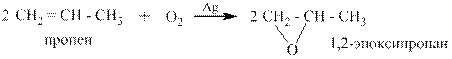
Эпоксидные соединения применяются для создания клеев различного назначения.
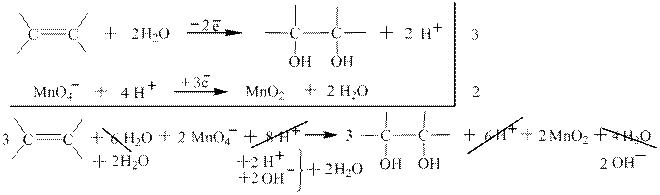
1.3 Окисление алкенов однопроцентным раствором перманганата калия в воде – качественная реакция на алкены Е.Е Вагнера.
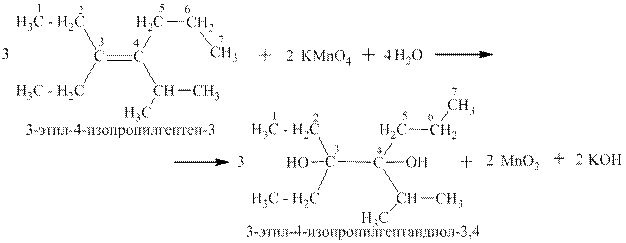
Реакция впервые описана Е.Е. Вагнером в «Журнале русского физико-химического общества» в 1886 году. Окисление алкенов или других непредельных соединений происходит при комнатной температуре и сопровождается исчезновением фиолетовой окраски перманганат-иона и выпадением бурого осадка диоксида марганца..Вне зависимости от строения алкена (но не алкадиена, например) коэффициенты в реакции Вагнера всегда одинаковые (324-322). Ниже приведены примеры окисления конкретных алкенов и показаны полуреакции и суммарная ОВР в ионном и молекулярном виде:
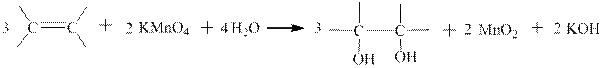
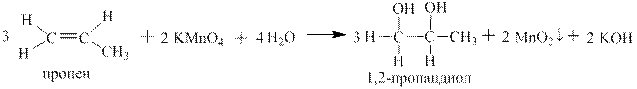
 :
:
Как видно в реакции Вагнера конечными органическими продуктами являются двухатомные спирты. Они называются так же гликолями. Например, 1,2-этандиол называется этиленгликолем.
1.4 Окисление алкенов сильными окислителями в жидкой фазе в кислой среде.
В зависимости от строения алкенов при окислении в этих условиях получаются различные продукты, а именно СО2, карбоновые кислоты и кетоны. Схема окисления алкенов различного строения приведена ниже.
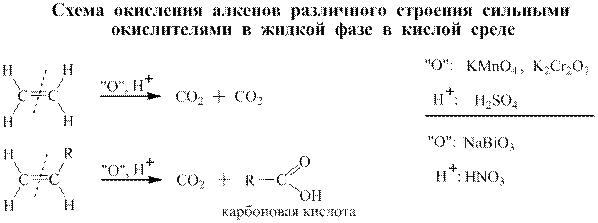
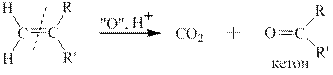
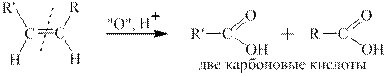
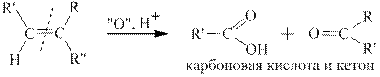
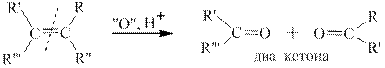
Для иллюстрации пользования этой схемой приведён пример окисления 2-метилпентена перманганатом калия в сернокислой среде. Согласно схеме окисления конечными органическими продуктами для данного алкена являются карбоновая кислота и кетон:
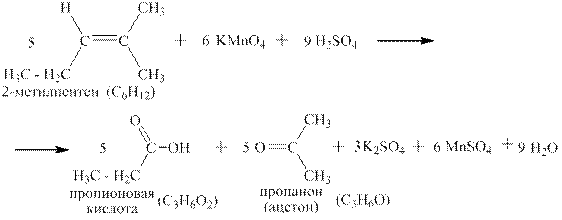
Полуреакции для этого процесса:
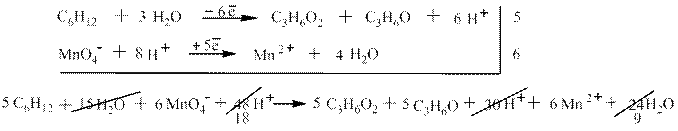 Другой пример: окисление 2-этилбутена-1 дихроматом калия в серной кислоте. В соответствии с правилами схемы окисления в этом случае получаются кетон и углекислый газ:
Другой пример: окисление 2-этилбутена-1 дихроматом калия в серной кислоте. В соответствии с правилами схемы окисления в этом случае получаются кетон и углекислый газ:
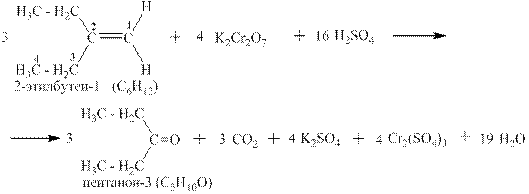
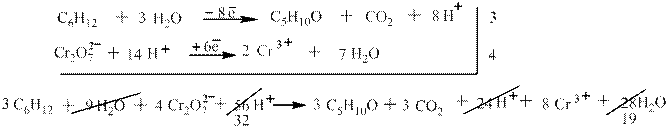
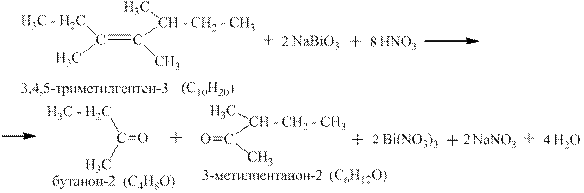
Третий пример: окисление цис-3,4,5-триметилгептена-3 висмутатом натрия в разбавленной азотной кислоте. В соответствии с правилами схемы окисления в данном случае получаются два кетона:
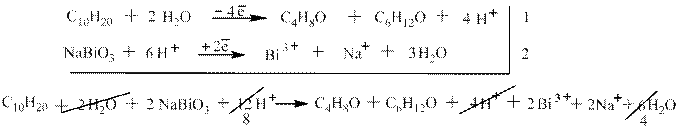
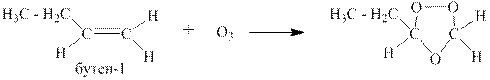
1.5 Озонолиз
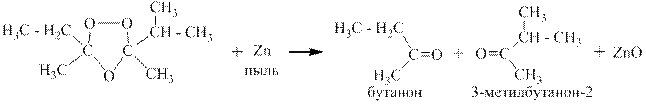
Озонолизом называется двухстадийный процесс, на первой стадии которого к алкену присоединяется озон и образуется озонид, а на второй стадии этот озонид либо медленно разрушается водой с образованием перекиси водорода, альдегидов и кетонов, либо быстро восстанавливается цинковой пылью с образованием оксида цинка и тех же альдегидов и кетонов.
Ниже приведён пример озонолиза 3-метил-цис-гептена-3.
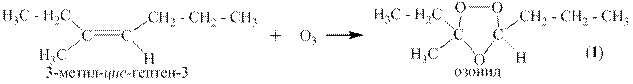
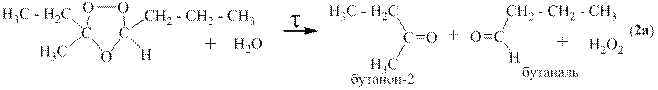
или:
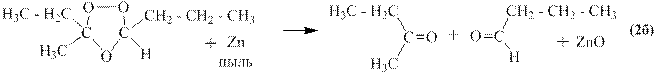
При озонолизе можно получить два различных кетона:
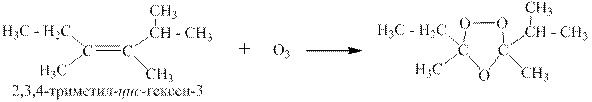
В качестве одного из продуктов окисления можно получить формальдегид (метаналь), если в реакцию взять терминальный алкен:
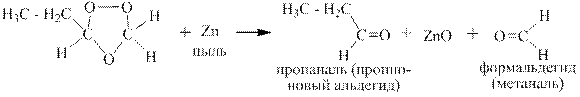
2. Реакции присоединения по двойной связи алкенов.
По двойной связи алкенов могут присоединять как неполярные, так и полярные молекулы.
Неполярные: Н2, Cl2, Br2, J2. Фтор F2 не присоединяется к алкенам, а сжигает их до СF4 и HF:
СН3 – СН = СН − СН3 + 12 F2 → 4 CF4 + 8 HF
2.1 Присоединение водорода.
Присоединение происходит только в присутствии катализатора. Чаще всего в промышленности используется палладий или платина, которые легко регенерируются путём прокаливания. Никель практически не используется, так как в условиях обычного прокаливания он превращается в оксид, восстанавливать который экономически не выгодно.
СН3 – СН = СН2 + Н2  СН3 – СН2– СН3
СН3 – СН2– СН3
2.2 Присоединение хлора.
Идёт к двум атомам при двойной связи. Получаются дихлорпроизводные алканов. Реакция может протекать как водном растворе при комнатной или более низких температурах, так и в органических растворителях, например, тетрахлорметане CCl4 или дихлорэтане C2H4Cl2:
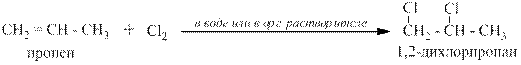
2.3 Присоединение брома.
Проходит аналогично как с бромной водой при температурах до 00С, так и в тех же органических растворителях. В последнем случае реакция может проходить и при температуре до – 250С, то есть на морозе.
Реакция с бромом является качественной на присутствие алкенов в газообразных и жидких смесях, так как сопровождается обесцвечиванием оранжевых бромных растворов:
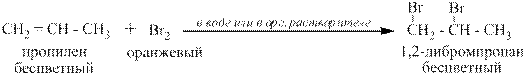
2.4 Реакция с йодом.
Реакция широко используется для определения общей ненасыщенности жиров, которые являются производными ненасыщенных жирных кислот, содержащих двойные связи, как в алкенах:
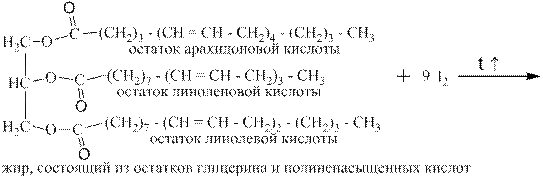
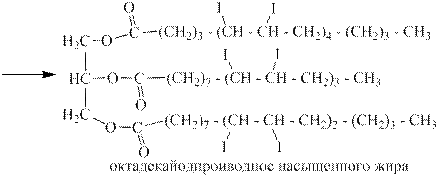
Массу йода в граммах, пошедшую на полное йодирование 100 г жира, называют йодным числом. Чем оно выше, тем полезнее жир для человека, так как только из полиненасыщенных жирных кислот организм синтезирует гормоны. Примеры йодных чисел: пальмовое масло – 12, бараний жир – 35, оливковое масло – 80, соевое масло – 150, жир сельди – 200, тюлений жир - 280
2.5 Реакции с полярными молекулами.
К полярным молекулам типа Н-А относятся следующие: H-F, H-Cl, H-Br, H-J, H-OH,
H-O-R(спирты) и карбоновые кислоты –
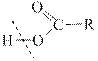
Присоединение хлороводорода и других полярных молекул идёт по , то есть атом водорода из полярной молекулы преимущественно присоединяется к более гидрогенизированному атому углерода при двойной связи, а остаток А к другому атому при двойной связи.

Таким образом реакция малоселективная.
При увеличении разности в гидрогенизированности селективность в реакции возрастает. Действительно разница в гидрогенизированности у атомов 1 и 2 в пропене составляет один атом водорода, и к менее гидрогенизированному атому углерода идёт 85% хлора, тогда как в
2-метилпропене разница в гидрогенизированности у атомов 1 и 2 составляет уже два атома водорода и к атому 2 идёт более 98% хлора:
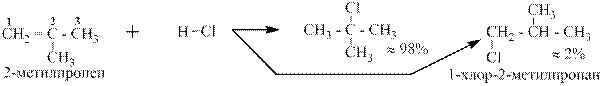
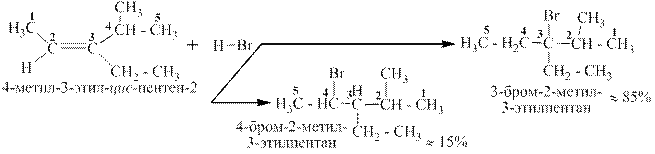
Аналогично идет присоединение HF, HBr, HJ:
Иначе идет присоединение HBr (и только HBr, а не HCl, HF и HI) в присутствии перекиси водорода H2O2:
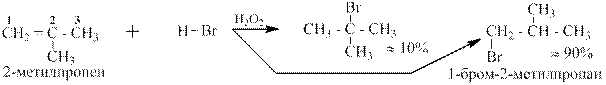
Эта реакция называется присоединением HBr по Карашу. Селективность в ней практически меняется на обратную в сравнении с таковой для присоединения HBr в отсутствии перекиси водорода (по правилу Марковникова).
Очень интересна реакция алкенов с хлором при 500ОС. В этих условиях реакция присоединения хлора по двойной связи обратима, более того равновесие в ней сильнейшим образом смещено в сторону исходных веществ. Наоборот гораздо более медленная, но необратимая реакция радикального замещения в аллильное положение, то есть рядом с двойной связью идёт до конца:
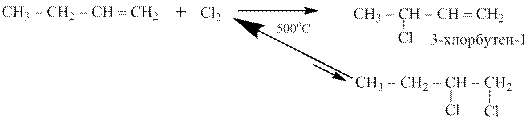
Эта реакция имеет большое практическое значение. Например, одна из стадий многотоннажного промышленного синтеза глицерина – хлорирование пропена до
3-хлорпропена-1.
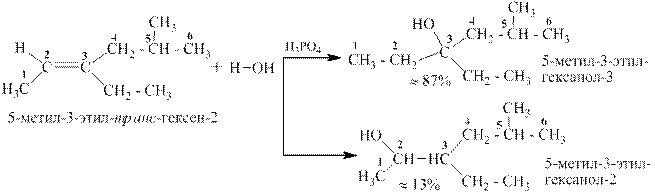
При присоединении воды к алкенам в присутствии каталитических количеств серной или ортофосфорной кислот получаются спирты. Присоединение идет по правилу Марковникова:
При присоединении спиртов к алкенам получаются простые эфиры:
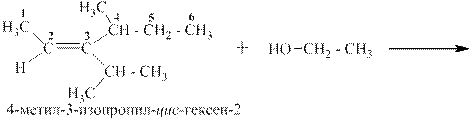
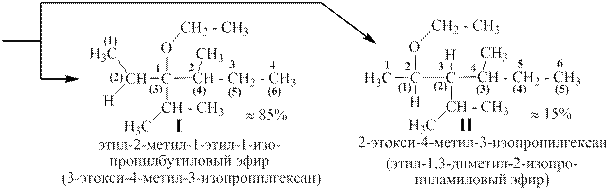
Эти изомерные эфиры можно назвать и как производные алканов, содержащие алкокси-заместители, и как простые эфиры. В первом случае выбирается самая длинная цепь из атомов углерода и нумеруется с той стороны, которая ближе к алкокси-заместителю. Например, для эфира Iцепь пронумерованная цифрами в скобках. И соответствующее название тоже в скобках. Для изомера II,наоборот цифрами в скобках пронумерована цепь, начинающаяся от атома углерода, связанного с атомом кислорода. Название в этом случае образуется так: сначала называют более простой радикал, связанный с атомом кислорода, затем более сложный и, наконец, добавляют «овый эфир».
При присоединении карбоновых кислот к алкенам получаются сложные эфиры:

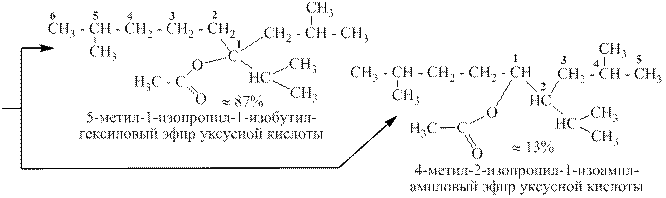
Названия сложных эфиров образуются так: сначала называют углеводородный радикал, связанный с кислородом. При этом за атом номер 1 принимают атом углерода, контактирующий с кислородом. От этого атома нумеруют самую длинную из имеющихся цепей. Группы атомов, не вошедшие в главную цепь, считают заместителями и перечисляют по обычным правилам. Затем добавляют «овый эфир такой-то кислоты».
