Цветные реакции многоатомных фенолов с хлорным железом
В четыре пробирки вносят соответственно в первую – 3 капли раствора пирокатехина, во вторую – 3 капли раствора резорцина, в третью – гидрохинона, в четвертую – пирогаллола. В каждую из пробирок вносят по 1 капле раствора хлорного железа. При этом в первой пробирке появляется зеленое окрашивание, во второй – фиолетовое, в третьей – зеленое, моментально переходящее в желтое, в четвертой – красное.
Одновременно с образованием фенолятов хлорное железо действует на фенолы и как окислитель.
Появление быстро изменяющейся зеленой окраски в пробирке с гидрохиноном указывает на то, что при окислении гидрохинона в хинон образуется промежуточное соединение одной молекулы хинона с молекулой бензохинона, т.н. хингидрон.
Привести химизм процесса
Зеленая окраска заметнее в первый момент попадания капли FeCI3 в раствор гидрохинона и в случае насыщенного раствора гидрохинона.
Цветные реакции многоатомных фенолов на фильтровальной бумаге
На полоску фильтровальной бумаги (3*7) наносят по 1 капле пирокатехина и пирогаллола. Когда капли расплывутся, в центр каждого пятна помещают по 1 капле хлорного железа – продукты окисления распределяются в виде концентрических колец, т.е. удается наблюдать эффект распределительной хроматографии на бумаге.
Окисление фенолов кислородом воздуха в щелочной среде
На полоску фильтровальной бумаги (10*3) наносят через равные промежутки по 1 капле растворов пирокатехина, резорцина, гидрохинона и пирогаллола. В центр каждого из полученных пятен помещают по 1 капле раствора щелочи. Пятно пирокатехина окрашивается в зеленый цвет, пирогаллола – в коричневый. Гидрохинон образует желтое пятно с зеленой каемкой по периферии. Резорцин только через некоторое время образует пятно коричневого цвета. Зеленое пятно пирокатехина постепенно начинает желтеть (происходит постепенное окисление до о-хинона).
Многоатомные фенолы легко окисляются под влиянием кислорода воздуха особенно в щелочной среде.
Химизм процесса (для пирокатехина).
Окисление фенолов нитратом серебра
Помещают предметное стекло на белую бумагу. Наносят на стекло через равные промежутки по 1 капле растворов пирокатехина, резорцина, гидрохинона и пирогаллола. К каждой капле добавляют по 1 капле раствора AgNO3. Быстрее всего восстанавливает серебро пирогаллол, затем гидрохинон и пирокатехин. Резорцин восстанавливает нитрат серебра значительно медленнее – через некоторое время появляется лишь слабое побурение раствора.
Привести схему окисления фенолов.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Чем отличается действие радикала фенила от действия углеводородных радикалов на свойства гидроксогруппы? Ответ подтвердите примерами.
2. Как изменяется подвижность атомов водорода в гидроксильной группе в ряду: пропиловый спирт – глицерин – фенол? Ответ подтвердите примерами реакций.
3. Напишите уравнения реакций взаимодействия брома с этиленом, ацетиленом, бензолом, фенолом и сравните условия их протекания.
4. Напишите уравнения реакций конденсации фенола с формальдегидом, ацетоном, уксусным альдегидом.
5. Предложите схему образования 2,4-динитрофенетола из хлорбензола.
6. Из толуола получите п-гидроксиметилфенол и напишите уравнения реакций последнего с РСI5 и NaOH.
7. Напишите уравнения реакций получения бензилацетата из толуола.
8. Как получить из бензола анизол? Написать уравнение реакции последнего с бромом.
9. Написать уравнения реакций получения п-бромфенола, м-нитроанизола, дифенилового эфира из бензола.
10. Напишите структурные формулы изомерных ароматических соединений состава С7Н8О и назовите их.
11. Напишите структурные формулы следующих соединений: а) п-нитро-фенола; б) п-бромфенола; в) 2-фенил-1- этанола; г) пикриновой кислоты
12. Напишите уравнения реакций следующих превращений:
бензол ® кумол ® Х ® фенол
13. Напишите уравнения реакций получения пирокатехина из бензола.
14. Приведите химизм процесса получения резорцина на основе бензола.
15. Определите строение вещества состава С7Н8О, которое не дает цветной реакции с хлоридом железа (III), при взаимодействии с РСI5 в соединение С7Н7СI7, окисляется перманганатом калия в вещество состава С7Н6О2, растворимое в водном растворе щелочи.
ЛАБОРАТОРНАЯ РАБОТА №8
Тема: АЛЬДЕГИДЫ И КЕТОНЫ
Цель работы: изучить характерные химические свойства карбонильных соединений.
Оборудование и реактивы: раствор едкого натра, 10%-ный; аммиачный раствор оксида серебра, 0,1н; формальдегид, 1%-ный и 40%-ный растворы; сульфат меди, 3%-ный раствор; фуксинсернистая кислота; ацетон; метиловый красный, 0,2%-ный раствор; нитропруссид натрия, 1%-ный раствор; уксусная кислота, 30%-ный раствор; соляная кислота концентрированная. Пробирки, пробиркодержатели, штативы для пробирок; спиртовка, водяная баня; “кипятильные камешки”.
Теоретическая часть
Альдегидами и кетонаминазывают производные углеводородов общей формулы СnH2nO, содержащие карбонильную (оксо-) группу С=О.
В альдегидах она связана с радикалом и водородом R-CН =O, в кетонах с двумя радикалами R2C=O. В зависимости от углеводородного радикала различают предельныеНСОН – формальдегид, СН3СОН – ацетальдегид, СН3СОСН3 – ацетон, непредельныеСН2=СНСОН – акролеин, СН3-СН=СНСОН – кротоновый альдегид, ароматические С6Н5СОН – бензальдегид, СН3-С6Н4-СОН – толуиловые альдегиды. Диальдегиды и дикетоны содержат две оксогруппы: СНОСНО – глиоксалевый альдегид, СНОСН2СНО – малоновый альдегид, СН3-СО-СО-СН3 – диацетил, бутандион (a-дикетон), СН3-СО-СН2-СО-СН3 –ацетилацетон, пентандион-2,4 (b-дикетон). Альдегиды и кетоны являются изомерами. Изомерия альдегидов и кетонов связана со строением углеродного скелета радикала, у кетонов она также определяется положением карбонильной группы.
Методы получения
1. Альдегиды и кетоны удобно получать пиролизом кислот и их смесей в виде паров над оксидами некоторых металлов(оксидом марганца, оксидом цинка) при 400-450 0С:
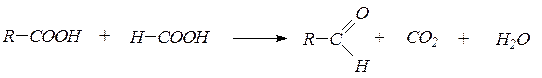
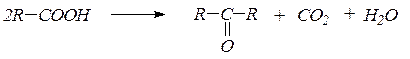
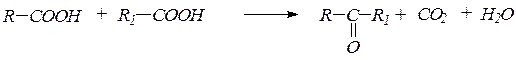
2. Гидратация ацетилена и его гомологовв условиях реакции Кучерова приводит соответственно к уксусному альдегиду и кетонам:
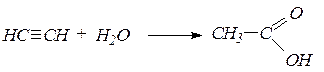
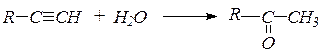
3. В технике альдегиды получают прямым присоединением СО и Н2 к олефинам:
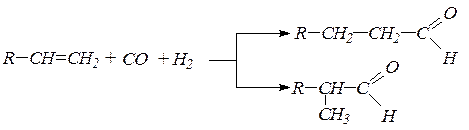
4. Альдегиды и кетоны получают окислением или каталитическим дегидрированием спиртов. При окислении первичных спиртов образуются альдегиды, а вторичных – кетоны:
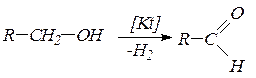
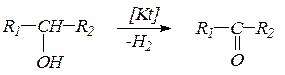
Физические свойства
Низшие альдегиды и кетоны – жидкости (за исключением муравьиного альдегида) легко растворимые в воде, имеющие специфический запах. Плотности альдегидов и кетонов ниже единицы. Альдегиды и кетоны кипят при температурах, значительно более низких, чем спирты с тем же числом атомов углерода, так как не являются сильно ассоциированными жидкостями из-за отсутствия водородной связи.
