Аналіз катіонів другої (хлоридної) аналітичної групи
Як вже зазначалось, до другої аналітичної групи відносять катіони Ag+, Hg22+, Pb2+.
Електронна будова цих йонів наступна:
Ag+ – [Kr]5s14d10; Hg22+ – [Xe]6s14f145d10; Pb2+ – [Xe]4f146p25d10.
Груповим реагентом на цю групу катіонів є розчин хлоридної кислоти з с(1/1HCl)=2,0моль/дм3.
Катіони Ag+, Hg22+, Pb2+ при взаємодії з хлорид-іонами утворюють малорозчинні у воді і в розведених кислотах осади:
Ag+ + Cl− → AgCl↓; Hg22+ + 2Cl− → Hg2Cl2↓; Pb22+ + 2Cl− → PbCl2↓;
У надлишку хлоридної кислоти утворені осади можуть частково розчинятись, переходячи у розчинні комплекси:
AgCl↓ + 2HCl → H2[AgCl3]; PbCl2↓ + HCl → H[PbCl3].
У киплячій воді розчинність PbCl2 збільшується втричі у порівнянні із розчинністю при 200С. За цих же умов розчинність AgCl та Hg2Cl2 відчутно аналітичними методами не зростає. Ця особливість використовується для відділення йонів Pb2+ від Ag+ та Hg22+.
За дії розчину амоніаку Hg2Cl2 перетворюється на димеркурійамоній хлорид, який швидко розкладається на малорозчинний меркурій амоній хлорид та металічну ртуть, яка надає осаду чорного забарвлення:
Hg2Cl2 + 2NH4OH → [Hg2NH2]Cl↓ + NH4+ + Cl– +2H2O;
[Hg2NH2]Cl → [HgNH2]Cl↓ + Hg.
Дією розчином амоніаку на суміш катіонів Ag+ та Hg22+ вдається їх розділити: йони Ag+ зв’язуються в розчинний комплекс [Аg(NH3)2]+, а йони Hg22+ – у нерозчинний комплекс [HgNH2]Cl.
4.2.1. Реакції виявлення катіонів Ag+
Специфічних реакцій виявлення катіонів Ag+ немає.
Дослід 1. Із загальних можливих реакцій можна зазначити дію на катіони Ag+ розчинами лугів NaOH або KOH. Як проміжний продукт спочатку утворюється білий осад AgOH, який під дією світла розкладається і утворюється осад аргентум оксиду бурого забарвлення:
Ag+ + OH– → AgOH↓;
2AgOH → Ag2O↓ + H2O.
Осад Ag2O дуже добре розчиняється у розчині амоніаку:
Ag2O + 4NH4OH → 2[Аg(NH3)2]ОН + 3H2O.
Слід зазначити, що молекулярної сполуки NH4OH як такої не
| існує. Насправді це комплекс | 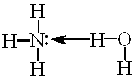 | , | який у водному |
середовищі дисоціює з утворенням йонів [NH4]+ та ОН−. По суті, гідроксид-іони походять з води, з якої протон відщеплюється і зв’язується у міцний комплекс [NH4]+ з константою нестійкості Кнест[NH4]+ =6·10–10. Рівноважна концентрація йонів Н+ у системі
[NH4]+ 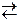 NH3 + H+ менша, ніж рівноважна концентрація гідроген-іонів у системі Н2О
NH3 + H+ менша, ніж рівноважна концентрація гідроген-іонів у системі Н2О 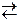 H+ + ОН–, тому середовище водного розчину амоніаку лужне.
H+ + ОН–, тому середовище водного розчину амоніаку лужне.
Дослід 2. Катіони Ag+ з хромат-іонами утворюють малорозчинний осад аргентум хромату цегельно-червоного кольору:
2Ag+ + CrO42– → Ag2CrO4↓.
Цю реакцію слід проводити при рН=5,5-7,5.
У присутності в розчині амоніаку осад не утворюється внаслідок включення йонів Ag+ в безбарвний водорозчинний комплекс [Аg(NH3)2]+:
Ag2CrO4 + 4NH3·H2O → 2[Аg(NH3)2]+ + CrO42– + 4H2O.
Осад аргентум хромату не утворюється також у сильнокислому середовищі. У сильнокислому середовищі хромат переходить у дихромат Ag2Cr2O7, який хоч і має забарвлення, але добре розчинний у воді.
Якщо в досліджуваному середовищі присутні йони, що утворюють з CrO42–-іонами також осади (наприклад, Pb2+, Ba2+ та інші), то вони будуть заважати виявленню йонів Ag+ за цією реакцією.
Дослід 3. Галогенід-іони (Br−, I−) утворюють з катіонами Ag+ осади AgBr жовтуватого забарвлення та AgI жовтого забарвлення:
Ag+ + Вr− → AgBr↓;
Ag+ + I− → AgI↓.
Аргентум йодид розчинний у надлишку реагенту внаслідок комплексоутворення:
AgI↓ + КI → К[AgI2],
а також можливе розчинення шляхом колоїдоутворення:
{m(AgI)·nI–∙(n–x)K+}−xK+.
4.2.2. Реакції виявлення катіонів Pb2+
Дослід 1. У лужному середовищі катіони Pb2+ утворюють малорозчинний у воді плюмбум гідроксид білого кольору:
Pb2+ + 2ОН− → Pb(ОН)2↓,
який розчинний як у кислотах, так і в концентрованих розчинах лугів:
Pb(ОН)2↓ + 2Н+ → Pb2+ + 2Н2О;
Pb(ОН)2↓ + 2Na+ + 2OH– → 2Na+ + [Pb(ОН)4]2–;
[Pb(ОН)4] 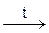 PbO22– + 2H2O.
PbO22– + 2H2O.
Якщо для розчинення був взятий натрій гідроксид, то утворюється водорозчинний натрій плюмбіт Na2PbO2.
Отже, при додаванні до розчину, що містить йони Pb2+, надлишку лугу, осад Pb(ОН)2 і не утворюється.
Дослід 2. При дії сульфат-іонів на йони Pb2+ утворюється малорозчинний PbSO4 (ДР(PbSO4)=1,6·10–8. На цій основі йони Pb2+ відносять також і до третьої (сульфатної) аналітичної групи катіонів.
При нагріванні осаду PbSO4 з розчинами лугів утворюються плюмбіти:
PbSO4 + 4OH− → PbO22– + 2H2O + SO42− .
Плюмбум сульфат розчиняється також у розчині амоній ацетату (w=30%). При цьому утворюється водорозчинний молекулярний комплекс [Pb(CH3COO)2PbSO4]:
2PbSO4 + 2CH3COO− → [Pb(CH3COO)2PbSO4] + SO42–.
Розчинність осаду PbSO4 підвищується у середовищі сильних кислот, так як при цьому йони SO42–, які утворюються за вищенаведеною реакцією, зв’язуються в аніони НSO4– і рівновага зміщується праворуч: Н+ + SO42– 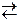 НSO4−.
НSO4−.
Дослід 3. Калій хромат та калій дихромат утворюють з катіонами Pb2+ малорозчинний плюмбум хромат жовтого кольору:
Pb2+ + CrO42– → PbCrO4↓.
Плюмбум хромат розчинний в розчинах гідроксидів:
PbCrO4 + 4NaOH → Na2[Pb(OH)4] + Na2CrO4;
PbCrO4 + 4OH– → [Pb(OH)4]2– + CrO42–,
але нерозчинний в оцтовій кислоті.
При взаємодії йонів Pb2+ з водним розчином амоніаку утворюються білі осади Pb(OH)2 або Pb(OH)Аn (Аn – однозарядний аніон), які не розчиняються у надлишку реагенту через відсутність схильності Плюмбуму до утворення комплексних амоніакатів.
Дослід 4. Специфічного реакцією на катіони Pb2+ є взаємодії їх з йодид-іонами:
Pb2+ + 2I− → PbI2↓.
При цьому утворюються осад оранжево-жовтого забарвлення.
При нагрівання осад PbI2 у присутності декількох крапель оцтової кислоти (с( 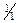 CH3COOН)=2моль/дм3) розчиняється, а при охолодженні знову утворюється у вигляді блискучих золотистих кристалів.
CH3COOН)=2моль/дм3) розчиняється, а при охолодженні знову утворюється у вигляді блискучих золотистих кристалів.
Реакцію утворення PbI2 слід проводити у кислому середовищі при рН=3-5.
У надлишку реагенту осад PbI2 розчиняється. При цьому утворюється водорозчинний комплекс [PbI4]2–:
PbI2 + 2KI → K2[PbI4].
Реакція йонів Pb2+ з йодид-іонами дозволяє виявити їх у присутності катіонів всіх аналітичних груп.
Дослід 5. Дуже чутливою реакцією на йони Pb2+ є їх взаємодія з дітізоном, при цьому утворюється хелатний комплекс плюмбум дітізонату, який має цегельно-червоне забарвлення:
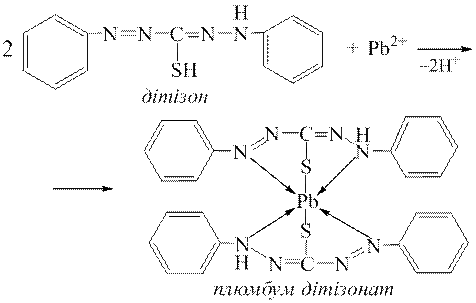
Визначенню йонів Pb2+ за реакцією з дітізоном заважають йони деяких важких металів (Fe3+, Cu2+, Ni2+, Zn2+ та ін.), які утворюють з дітізоном забарвлені хелатні комплекси.
Дослід 6. Леткі сполуки Плюмбуму забарвлюють полум’я у світло-блакитний колір.
4.2.3. Реакції виявлення катіонів [Нg2]2+
У комплексному меркурій(І)-іоні [–Hg–Hg–]2+ ступінь окиснення Меркурію становить 1+.
Дослід 1. При дії групового реагенту катіони [Нg2]2+ утворюють дуже малорозчинний Hg2Cl2 білого кольору, який чорніє при додаванні водного розчину амоніаку з утворенням осаду
[NH2Hg]Cl + Hg. Цей змішаний осад розчиняється повністю тільки при кип’ятінні з концентрованою нітратною кислотою:
3[NH2Hg]Cl + 3Hg + 14H+ + 14NO3−→ 6Hg2+ + 12NO3− + 3NH4+ + 3Cl− + 4H2O +2NO.
Дослід 2. У лужному середовищі йони [Нg2]2+ утворюють осад меркурій(І) оксиду, який має чорне забарвлення:
[Нg2]2+ + 2OH– → Hg2O↓ + H2O.
Hg2O розкладається на HgO та Hg.
Дослід 3. З водним розчином амоніаку меркурій(І)-іони утворюють малорозчинний комплекс димеркурійамоній хлориду [Нg2NH2]Cl.
Дослід 4. З хромат-іонами йони [Нg2]2+ утворюють осад
| червоного кольору меркурій(І) хромату | 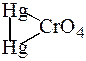 | , який нерозчинний |
в розчинах лугів та погано розчинний у розведеній нітратній кислоті.
Дослід 5. Йони [Нg2]2+ можна виявити відновлюючи їх до металічної ртуті досить сильним відновником, наприклад Sn2+ у вигляді станум(ІІ) хлориду. Розчин SnCl2 має бути
свіжоприготовлений з наявністю у розчині хлоридної кислоти та гранул олова на дні посудини.
Спочатку утворюється осад білого кольору Hg2Cl2:
[Нg2]2+ + 2Сl– → Hg2Cl2↓,
який далі взаємодіє з йонами Sn2+:
Hg2Cl2 + Sn2+ → 2Hg↓ + Sn4+ + 2Сl–.
Від металічної ртуті вміст пробірки набуває чорного забарвлення.
Дослід 6. Виявити йони [Нg2]2+ можна також за допомогою реакції з металічною міддю. Мідну пластинку зачищають наждачним папером до блискучого стану, а потім на очищену поверхню наносять краплю розчину Hg2(NO3)2. Через декілька хвилин спостерігають утворення сірої плями металічної ртуті:
Hg2(NO3)2. + Сu → Сu(NO3)2. + 2Hg↓.
Якщо утворену пляму протерти фільтрувальним папером, то пляма стане дзеркально блискучою. Проведенню цієї реакції заважають сильні окисники.
Дослід 7. Катіони [Нg2]2+ з дифенілкарбазоном утворюють сполуку синього забарвлення:
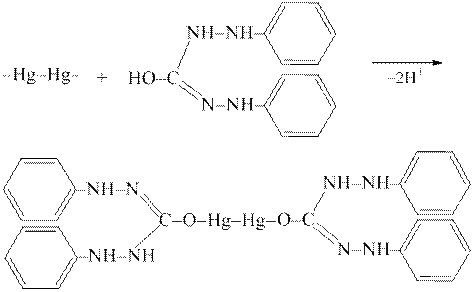
Для проведення цієї реакції на скляну платівку наносять краплю розчину солі Hg2(NO3)2, додають краплю розчину розведеної (w=2%) нітратної кислоти та краплю розчину дифенілкарбазону. Забарвлення стає синім або фіолетовим.
Таке ж забарвлення дають йони Hg2+ та CrO42–, тому перед визначенням йонів [Нg2]2+ йони, що заважають, мають бути видалені.
У нейтральних та оцтовокислих розчинах катіони Cu2+, Fe2+, Fe3+, Cr3+, Co2+, та інші теж утворюють з дифенілкарбазоном забарвлені сполуки, а тому заважають виявленню йонів [Нg2]2+ за цією реакцією.
Дослід 8. При взаємодії катіонів [Нg2]2+ з калій йодидом утворюється дуже малорозчинний Hg2I2 жовто-зеленого забарвлення:
[Нg2]2+ + 2I– → Hg2I2↓,
який розчиняється у великому надлишку реактиву з утворенням комплексу калій тетрайодмеркурію та металічної ртуті:
Hg2I2 + 2КI → К2[НgІ4] + Hg↓.
