Вода дистиллированная, не содержащая углекислоты ГОСТ 4517-87
ЛАБОРАТОРНАЯ РАБОТА
Тема. Приготовление и стандартизация раствора гидроксида натрия. Определение уксусной кислоты.
Цель. Ознакомиться со способами приготовления раствора гидроксида натрия и его стандартизации. Приготовить 0,1 М раствор гидроксида натрия и стандартизовать его. Определить концентрацию уксусной кислоты.
Техника безопасности. Соблюдать правила техники безопасности при работе со щелочью и кислотой, стеклянной посудой и вредными веществами.
Приборы, посуда, реактивы: штатив, весы аналитические, разновес; бюретка 25 мл, пипетка емк. 20 мл, колбы мерные емк. 200 – 250 мл, склянка емк. 1 л, воронки, часовое стекло; насыщенный раствор гидроксида натрия, раствор гидроксида натрия с концентрацией 0,1 М, щавелевая кислота по ГОСТ, х.ч., перекристаллизованная, фенолфталеин по ГОСТ, 0,1% спиртовой раствор, дистиллированная вода, не содержащая СО2 по ГОСТ.
Приготовление рабочего раствора NaOH не содержащего карбонатов
РАБОТАТЬ В ЗАЩИТНЫХ ОЧКАХ!
Готовят насыщенный раствор щелочи. Гидроксид натрия растворяют в равной по массе количеству воды. Раствор при этом сильно разогревается, поэтому растворение ведут в жаростойкой стеклянной или фарфоровой посуде. Щелочь добавляют постепенно при перемешивании, чтобы избежать местного перегрева. После охлаждения раствор оставляют на 2-3 недели в склянке, закрытой резиновой пробкой. Примесь карбоната натрия при этом выпадет в осадок.
Отбирают пипеткой 4-5 мл раствора щелочи (~50%) осторожно, чтобы не взмутить осадок на дне цилиндра и разбавляют до 1 л дистиллированной водой, не содержащей СО2.
Для расчета необходимого количества объема концентрированного раствора щелочи измеряют его плотность при помощи ареометра и по табл. (Справочник по аналитической химии. – М.: Химия, 1989) находят массовую долю ω(NaOH), %. По этим данным рассчитывают количества раствора и воды, необходимые для приготовления 1 л ~ 0,1 М раствора NaOH.
Растворы щелочей хранят в стеклянных бутылях с резиновой пробкой, снабженной трубкой с натронной известью для защиты от СО2 воздуха.
Вода дистиллированная, не содержащая углекислоты ГОСТ 4517-87
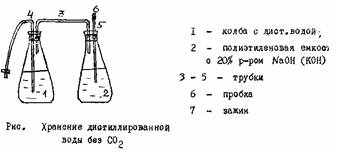
Дистиллированную воду в колбе нагревают до кипения и кипятят в течение 30 мин. (до появления крупных пузырей). Затем колбу закрывают пробкой, в которую вставлена стеклянная трубка, соединенная с помощью резиновой трубки с промывной склянкой. Склянка содержит раствор гидроксида натрия или гидроксида калия с массовой долей 20%.
Освободить дистиллированную воду от СО2 можно также путем длительного хранения (в течение недели) в открытом сосуде, защищенном от пыли.
Приготовление стандартного раствора щавелевой кислоты
С(½ Н2С2О4·2Н2О)=0,1 моль/л
Навеску свежеперекристаллизованной щавелевой кислоты Н2С2О4·2Н2О 1,5759 г взвешивают на аналитических весах с точностью до 0,0002 г, переносят в чистую мерную колбу вместимостью 250 мл через воронку. Бокс или стекло с остатками веществе снова взвешивают и по разности находят массу щавелевой кислоты, внесенную в колбу. Результат взвешивания на аналитических весах заносят в рабочий журнал по форме:
Масса бюкса (стекла) с щавелевой кислотой
Масса бюкса (стекла) с остатками щавелевой кислоты
Масса щавелевой кислоты
Дистиллированной водой, свободной от СО2 из промывалки тщательно сливают остатки вещества с воронки в колбу, обмывают воронку водой и вынимают ее из колбы. Перемешивая плавными круговыми движениями, полностью растворяют щавелевую кислоту, вливая в колбу новые порции воды и перемешивая, но не более, 2/3 вместимости ее. Раствор доливают при комнатной температуре до метки дистиллированной водой так, чтобы нижний край мениска касался метки. Для этого с помощью медицинской пинетки добавляют необходимое количество дистиллированной воды. Мерную колбу закрывают пробкой, тщательно перемешивают, переворачивая колбу несколько раз. Раствор переливают в склянку. Склянка для хранения должна быть чистой и ополоснута не менее 2-3 раз раствором щавелевой кислоты. На склянке должна быть этикетке с указанием фамилии студента, концентрации приготовленного раствора, даты изготовления и температуры, при которой проводилась работа.
Следует отметить, что растворы щавелевой кислоты неустойчивы при хранении. Поэтому рекомендуется провести стандартизацию раствора NaOH по щавелевой кислоте в день их приготовления.
Стандартизация раствора NaOH по щавелевой кислоте
Стандартизация методом пипетирования. Приготовленным раствором NaOH заполняют чистую бюретку, предварительно споласкивая ее раствором NaOH не менее 2-3 раз. Устанавливают уровень раствора на нулевой отметке (по нижнему мениску). В колбу для титрования отбирают пипеткой на 20 мл (пипетка должна быть ополоснута раствором не менее 2-3 раз) раствора щавелевой кислоты, прибавляют 2-3 капли фенолфталеина и титруют раствором NaOH до появления при взбалтывании в течение 1-2 мин красной окраски. При отборе раствора щавелевой кислоты при помощи пипетки соблюдают следующие правила. Раствор засасывают при помощи груши немного выше метки. Снимают грушу, осторожно сливают избыток раствора так, чтобы мениск жидкости совпадал с меткой. После этого отверстие пипетки зажимают и переносят в колбу для титрования. Верхнюю часть пипетки открывают и дают жидкости спокойно вытечь. Последние капли сливают, касаясь стенки колбы. В таком состоянии пипетку оставляют на 10 с. Выдувать оставшуюся жидкость из пипетки нельзя. Раствор из бюретки должен вытекать медленно, добавляют раствор порциями ~ 1 мл, при постоянном вращении колбы. По мере приближения конца титрования уменьшают объём титранта, вблизи от точки эквивалентности добавляют реагент по каплям. Обмывают стенки колбы, прежде чем закончить титрование. После вытекания раствора отсчет делений на бюретке производят спустя 20-30сек, чтобы дать возможность стечь жидкости, оставшейся на стенках бюретки. Отсчет снимают по нижнему краю мениска. Если край мениска точно не совпадает с деланием бюретки, то отсчитывают, сотые доли мл с точностью до 0,02 - 0,03 мл. При записи результатов следует приводить два десятичных знака, например, 23,00, а не 23,0 или 23. Для получения достоверных результатов повторяют титрование не менее 3 раз и для вычисления берут средний результат. Каждое повторное титрование начинают от нулевого отсчета бюретки. Объем раствора титранта, пошедший на титрование, должен превышать 10 мл.
Расчет молярной концентрации раствора гидроксида натрия вычисляют по формуле:
| С(NaOH) = | С(½ Н2С2О4·2Н2О)·V(Н2С2О4) |
| V(NaOH) |
где С(NaOH) – молярная концентрация раствора NaOH, моль/л;
С(½ Н2С2О4·2Н2О) – молярная концентрация эквивалента раствора щавелевой кислоты, моль/л;
V(Н2С2О4) – объем раствора щавелевой кислоты, взятый для титрования;
V(NaOH) – объем раствора NaOH, пошедшего на титрование, мл.
Влияние температуры. Если в лаборатории температура отличается от комнатной (20°С), вводят поправку на изменение объема. Заметное влияние на точность обычных измерений объема наблюдается при колебании температуры примерно на 5 градусов.
Пользуются формулой:
V20 = VI·(1+0,001P),
где V20 - искомый объем раствора при 20°С;
VI·- объем раствора, измеряемый при температуре опыта;
Р - поправка при той температуре, при которой измерен объем (табличные данные В.М. Сусленникова, Е.М.Киселева. Руководство по приготовлению титрованных растворов. - Л.: Химия, 1978.- С. 15).
В практической работе удобнее, учитывая температурную поправку, пересчитывать не объем раствора, а его коэффициент поправки по следующей формуле:
К1 = К·[1-0,001·(Р-Р1)],
где К – коэффициент поправки раствора при температуре в день установки титра;
К1 – коэффициент поправки раствора при температуре в день использования раствора;
Р-Р1 – поправки, взятые для соответствующих температур из табл. 1
Пример. Определить коэффициент поправки 0,1 н раствора при t1 = 24°C, если он был установлен при t = 1524°C и в этих условиях был равен 1,000:
К24 = 1,000·[1-0,001·(0,76 +0,80)] = 0,9984
Таблица 1. Поправка на температуру для коэффициентов поправки 0,1 н растворов
| t, °C | Величина поправки | t, °C | Величина поправки | t, °C | Величина поправки |
| -0,0014 | -0,0009 | +0,0006 | |||
| -0,0014 | -0,0008 | +0,0008 | |||
| -0,0013 | -0,0006 | +0,0010 | |||
| -0,0013 | -0,0005 | +0,0013 | |||
| -0,0013 | -0,0003 | +0,0015 | |||
| -0,0012 | -0,0002 | +0,0018 | |||
| -0,0012 | ±0,0000 | +0,0020 | |||
| -0,0011 | +0,0002 | +0,0023 | |||
| -0,0010 | +0,0004 |
Для 0,1 н растворов поправки на температуру могут быть взяты непосредственно из табл. 1. При этом выводят алгеброическую разность между поправками, найденными в табл. 1 для температур t и t1. Абсолютную величину этой разности прибавляют к коэффициенту поправки, установленному при температуре t, если t > t1 и вычитают, если t < t1.
Пример. Для t = 15°C и t1 = 24°C
К24 = 1,000 - [(-0,0008)-(+0,0008)] = 1,000 – 0,0016 = 0,9984
