Особенность строения органических соединений.
Органические и неорганические соединения.
Органические соединения, органические вещества — класс химических соединений, в состав которых входит углерод.
Исключение составляют несколько наиболее простых соединений углерода (например, карбиды, карбонаты, оксиды углерода, угольную кислоту, цианиды). Эти соединения считают неорганическими.
Органические соединения получили своё название из-за того, что в природе они встречаются почти исключительно в организмах животных и растений, принимают участие в жизненных процессах или же являются продуктами жизнедеятельности или распада организмов.
В отличие от органических соединений, такие вещества, как песок, глина, различные минералы, вода, оксиды углерода, угольная кислота и её соли и прочие вещества, относящиеся к «неживой природе», получили название неорганических или минеральных веществ.
Как углерод, входя в состав всех органических веществ, является важнейшим элементом животного и растительного царств, так кремний – главный элемент царства минералов и горных пород.
История открытий органических соединений.
Долгое время считалось, что углеродосодержащие вещества, образующиеся в организмах, в принципе невозможно получать путём синтеза из неорганических соединений.
Образование органических веществ приписывалось влиянию особой, недоступной познанию «жизненной силы», действующей только в живых организмах, и обуславливающих специфику органических веществ.
Это учение получило название витализма (от латинского vis vitalis – жизненная сила).
Концепция виталистов была наиболее полно сформулирована одним из самых авторитетных химиков первой половины XIX века шведским учёным Берцелиусом.
В 1824 г. немецкий физик Велер, ученик Берцелиуса, впервые получил из неорганического вещества дициана (CN)2 при нагревании его с водой щавелевую кислоту (COOH)2 – органическое соединение, которое до тех пор добывалось только из растений.
В 1828 г. Велер осуществил первый синтез вещества животного происхождения: нагреванием неорганического соединения цианата амония NH4CNO получил мочевину (карбамид) (NH2)2CO. До этого момента карбамид выделяли лишь из мочи.
Вскоре были осуществлены в лабораторных условиях синтезы и других органических веществ:
· В 1845 г. в Германии Г. Кольбе синтезировал уксусную кислоту,
· В 1854 г. во Франции М. Бертло синтетическим путём получил жир,
· В 1861 г. в России А.М. Бутлеров осуществил синтез сахаристого вещества.
В настоящее время путём синтеза получают множество органических соединений. Более того, - оказалось, что многие органические вещества гораздо проще и дешевле получить синтетически, чем выделять из природных продуктов.
Наибольшим успехом химии 50-60-х годов XX века явился первый синтез простых белков – гормона инсулина и фермента рибонуклеазы.
Таким образом, доказана возможность синтетического получения даже белков – наиболее сложных органических веществ, являющихся непременными участниками жизненных процессов.
Особенность строения органических соединений.
Органические соединения имеют важную особенность. Она состоит в том, что атомы углерода обладают уникальной способностью образовывать длинные цепочки и присоединять к себе многие другие атомы, например, атомы водорода, кислорода, азота, серы, фосфора.
Причём, образованные таким образом молекулы, являются вполне устойчивыми, тогда как молекулы с подобным же цепеобразным накоплением атомов других элементов в подавляющем большинстве случаев очень непрочны.
Например, для кислорода максимальная известная длина цепи равна двум атомам, а содержащие ее соединения (перекись водорода и ее производные) малоустойчивы.
Длинные цепи углеродных атомов – причина огромного разнообразия органических соединений. По этой причине существуют неисчислимые комбинации сочетаний атомов, образующих молекулы таких соединений.
Так общее число известных неорганических соединений на сегодняшний день составляет несколько десятков тысяч, а число органических соединений уже перевалило за два миллиона.
Это обстоятельство заставляет выделить детальное изучение химии углерода в самостоятельную область, называемую органической химией.
Органическая химия
Структурная изомерия и структурные формулы
Структурная изомерия
Среди органических соединений распространено явление изомерии. Имеется множество соединений углерода, обладающих одинаковым качественным и количественным составом и одинаковым молекулярным весом, но совершенно различными физическими, а зачастую и химическими свойствами.
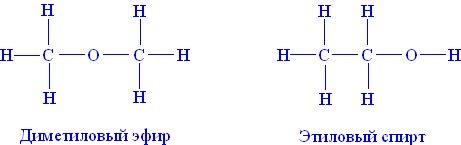
Например, состав С2Н6О и, соответственно молекулярный вес 46,07 имеют два различных изомерных органических вещества:
1. этиловый спирт – жидкость, кипящая при 78,4 С, смешивающаяся с водой в любых соотношениях и
2. диметиловый эфир – газ, почти не растворимый в воде и существенно отличающийся от этилового спирта по химическим свойствам.
Другой пример:
Формула С2Н4О2 может соответствовать как уксусной кислоте, так и гликолевому альдегиду.
Структурные формулы
Для того чтобы избежать путаницы для записи формул таких веществ используют структурные формулы.
Структурная формула — это разновидность химической формулы, графически описывающая расположение и порядок связи атомов в соединении, выраженное на плоскости. Связи в структурных формулах обозначаются валентными черточками.
Так, структурные формулы веществ, приведённых в качестве примеров выше, будут выглядеть следующим образом:

Подобное графическое изображение структурных формул довольно сложно и требует времени. Часто формулы органических соединений пишут таким образом, чтобы они давали представление о длине углеводородной цепи и о присутствующих в молекуле функциональных группах.
Выделение фунуциональных групп важно потому, что именно они во многом определяют химические свойства соединения Так, формулы вышеприведённых веществ могут быть записаны следующим образом:
1. СН3 – О – СН3 – диметиловый эфир,
2. С2Н5 – ОН – этиловый спирт (ОН - гидроксильная группа),
3. СН3 – СООН – уксусная кислота (СООН - карбоксильная группа),
4. СН2ОН – СНО – гликолевый альдегид (СНО - альдегидная группа).
Внешняя электронная оболочка атома углерода состоит из четырех электронов, с помощью которых он образует четыре ковалентных связи с другими атомами. С помощью простых (одинарных) ковалентных связей атом углерода может присоединить к себе четыре других атома.

Но атомы могут связываться не только одинарной, но и двойной или тройной ковалентной связьюсвязью.
В структурных формулах такие связи обозначаются двойными или тройными чёрточками. Примерами соединений с двойными и тройными связями являются этиленС2Н4 и ацетилен С2Н2:

Углерод. Особенности строения. Свойства.
Строение углерода
Углерод является шестым элементом периодической системы Менделеева. Его атомный вес равен 12.
Углерод находится во втором периоде системы Менделеева и в четвёртой группе этой системы.
Номер периода сообщает нам, что шесть электронов углерода располагаются на двух энергетических уровнях.
А четвёртый номер группы говорит, что на внешнем энергетическом уровне у углерода находится четыре электрона. Два из них это спаренные s-электроны, а два другие – не спаренные р-электроны.
Структура внешнего электронного слоя атома углерода может быть выражена следующими схемами:
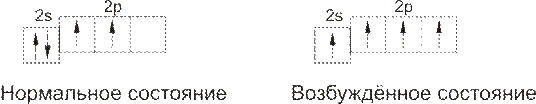
Каждая ячейка вэтих схемах означает отдельную электронную орбиталь, стрелка – элетрон, находящийся на орбитали. Две стрелки внутри одной ячейки – это два электрона, находящиеся на одной орбитали, но имеющие противоположно направленные спины.
При возбуждении атома (при сообщени ему энергии) один из спаренных S-электронов занимает р-орбиталь.
Возбуждённый атом углерода может учавствовать в образовании четырёх ковалентных связей. Поэтому в подавляющем большинстве своих соединений углерод проявляет валентность, равную четырем.
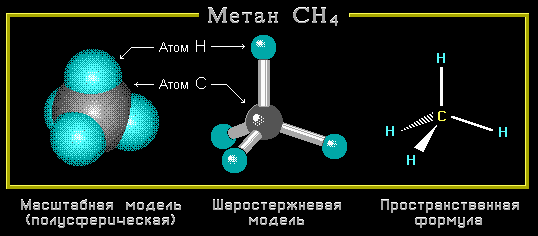
Так, простейшее органическое соединение углеводород метан имеет состав СН4. Строение его может быть выражено структурной или электронной формулами:

Электронная формула показывает, что атом углерода в молекуле метана имеет устойчивую восьмиэлектронную внешнюю оболочку, а атомы водорода – устойчивую двухэлектронную оболочку.
Все четыре ковалентных связи углерода в метане (и в других подобных соединениях) равноценны и симметрично направлены в пространстве. Атом углерода находится как бы в центре тетраэдра (правильной четырёхугольной пирамиды), а четыре соединённых с ним атома (в случае метана – четыре атома водорода) в вершинах тетраэдра.
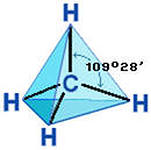
Углы между направлениями любой пары связей одинаковы и составляют 109 градусов 28 минут.
Это объясняется тем, что в атоме углерода, когда он образует ковалентные связи с четырьмя другими атомами, из одной s- и трёх p-орбиталей в результате sp3-гибридизации образуются чтыре симметрично расположенные в пространстве гибридные sp3-орбитали, вытянутые в направлении к вершинам тетраэдра.