Аналіз катіонів п’ятої (гідроксидної) аналітичної групи
До п’ятої аналітичної групи відносять катіони Fe2+, Fe3+, Mg2+, Mn2+, Bi3+, Sb3+, SbV.
Електронна будова катіонів п’ятої аналітичної групи:
Fe2+ − [Ar] 3d6; Fe3+ − [Ar] 3d5; Mg2+ − [Ne] ; Mn2+ − [Ar] 3d5; Bi3+ − [Xe]
4f145d106p2; Sb3+ − [Kr] 4d105p2.
Ці елементи, за винятком Bi та Mg, проявляють у сполуках змінну ступінь окиснення та схильні до комплексоутворення.
Гідроксиди катіонів цієї аналітичної групи, окрім Sb(OH)3, не мають амфотерних властивостей та не утворюють розчинних амінокомплексів.
При дії надлишку групового реагенту – розчину лугу NaOH або КОН на катіони п’ятої аналітичної групи утворюються дуже малорозчинні відповідні гідроксиди:
ДР(Fe(OH)2)=7,2·10–16; ДР(Fe(OH)3)=3,2·10–40;
ДР(Mg(OH)2)=6,0·10–10; ДР(Bi(OH)3)=4,3·10–31;
ДР(Mn(OH)2)=1,9·10–13.
Нерозчинність гідроксидів катіонів п’ятої аналітичної групи (окрім Sb(OH)3) у розчині лугів та розчині амоніаку є характерною особливістю цієї групи катіонів. Але ці гідроксиди легко розчиняються у розчинах хлоридної, сульфатної, нітратної кислот.
Всі солі Стибію та Бісмуту легко гідролізуються з утворенням відповідних основних солей:
SbCl3 + H2O  SbOCl↓ + 2HCl;
SbOCl↓ + 2HCl;
SbCl5 + 2H2O  SbO2Cl↓ + 4HCl.
SbO2Cl↓ + 4HCl.
Особливо легко гідролізуються нітрати Стибію, що дає можливість відділити Стибій від інших катіонів п’ятої аналітичної групи.
BiCl3 + 2H2O  Bi(OH)2Cl↓ + 2HCl;
Bi(OH)2Cl↓ + 2HCl;
Bi(OH)2Cl  BiOCl↓ + H2О.
BiOCl↓ + H2О.
У дещо меншій мірі, але аналогічно, гідролізується і бісмут нітрат з утворенням бісмутит нітрату BiONO3. Для попередження гідролізу до водних розчинів солей Стибію та Бісмуту завжди додається відповідна кислота, внаслідок чого розчини мають кислу реакцію. Виходячи з цього, якщо досліджуваний на катіони п’ятої аналітичної групи розчин має нейтральну реакцію і при цьому не має осаду, то це може бути ознакою, що в такому розчині відсутні катіони Sb3+, Sb5+, Bi3+. Якщо ж досліджуваний розчин мутний або має білий осад і разом із тим має нейтральну або слабкокислу реакцію, то в цьому розчині можуть бути катіони Стибію або Бісмуту, або ж обидва разом.
В дуже незначній мірі гідролізуються також солі Fe3+. При нагріванні розчинів гідроліз цих солей підсилюється.
Стибій(ІІІ) гідроксид Sb(OH)3, або метастибійна кислота HSbO2, білого кольору порівняно легко розчиняється як у кислотах, так і в розчинах лугів:
HSbO2 + 3Н+ → Sb3+ + 2H2O;
HSbO2 + OН− → SbO2− + H2O.
Під дією нітратної кислоти метастибійна кислота окиснюється до стибійної H3SbO4, яку можна виразити також як nSb2O5·mH2O. Вона розчиняється тільки в концентрованих розчинах лугів і хлоридної кислоти.
Розчинні карбонати з усіма катіонами п’ятої аналітичної групи утворюють осади: з катіонами Mn2+ та Fe2+ – MnCO3 та FeCO3; з катіонами Mg2+, Fe3+, Bi3+ – основних карбонатів Mg2(OH)2CO3, Fe(OH)CO3, Bi(OH)CO3; з катіонами Sb3+ та SbV – Sb(OH)3 i nSb2O5·mH2O. Всі осади, за винятком Fe(OH)CO3, білого кольору. Fe(OH)CO3 має буре забарвлення. Ферум(ІІ) карбонат FeCO3 на повітрі легко окиснюється до Fe(OH)CO3, внаслідок чого забарвлення його вже в момент утворення набуває бурого кольору.
Всі ці карбонати легко розчиняються в мінеральних кислотах, а основний магній карбонат, крім того, легко розчиняється у розчинах амонійних солей:
Mg2(OH)2CO3 + 4NH4Cl → 2MgCl2 + 2NH3·H2О + (NH4)2CO3.
Амоній карбонат повністю гідролізується:
(NH4)2CO3 + H2O  2NH3·H2O + CO2.
2NH3·H2O + CO2.
Загальне рівняння реакції набуває вигляду:
Mg2(OH)2CO3 + 4NH4Cl + H2O → 2MgCl2 + 4NH3·H2O + CO2.
Ця властивість Mg2(OH)2CO3 використовується для відділення катіонів Mg2+ від інших катіонів п’ятої аналітичної групи.
Гідрофосфат-іони з усіма катіонами п’ятої аналітичної групи утворюють білі аморфні осади: з катіонами Fe2+, Fe3+, Mn2+, Bi3+ утворюють середні фосфати Fe3(PO4)2, FePO4, Mn3(PO4)2 та BiPO4; з катіонами Mg2+ – магній гідрофосфату MgHPO4; з катіонами Стибію – відповідні гідроксиди внаслідок гідролізу фосфатних солей Стибію.
На відміну від інших катіонів п’ятої аналітичної групи, катіони Mg2+ при взаємодії з гідрофосфат-іонами у присутності амоніаку та йонів амонію утворюють характерний дрібнокристалічний осад подвійної солі магній-амоній фосфату:
Mg2+ + NH4OH + HPO42– → NH4MgPO4↓ + H2O.
Ця реакція, зазвичай, і застосовується для виявлення катіонів Mg2+ у розчинах.
При взаємодії сульфід-іонів у розчині хлоридної кислоти з катіонами Sb3+, Sb5+, Bi3+ утворюються осади відповідних сульфідів: Bi2S3 – чорного кольору; Sb2S3 та Sb2S5 – яскраво-оранжевого кольору. Сульфіди інших катіонів п’ятої аналітичної групи у хлоридній кислоті розчинні. Тому з H2S у кислому середовищі вони осадів не утворюють.
Отже, якщо через окрему пробу досліджуваного розчину, підкисненого хлоридною кислотою, пропустити гідроген сульфід, то утворення чорного осаду буде свідчити про наявність у цьому розчині катіонів Bi3+. Якщо ж при відсутності у розчині йонів Bi3+ при пропусканні через цей розчин H2S утворюється оранжевий осад – то це вказує на наявність у розчині катіонів Sb3+ або Sb5+, а катіони Bi3+ відсутні. Ця реакція часто застосовується для виявлення катіонів Sb3+ та Sb5+ у розчинах, оскільки забарвлення Sb2S3 та Sb2S5 є дуже характерним і відрізняється від забарвлення сульфідів інших металів.
У присутності солей амонію о-оксихінолін з усіма катіонами п’ятої аналітичної групи утворює осади, серед яких осад внутрішньокомплексної солі магній оксихінолінату являє собою характерні зеленувато-жовті кристали:
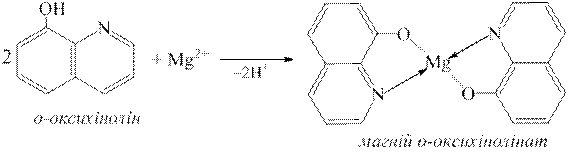
4.6.1. Реакції виявлення катіонів Fe2+
Дослід 1. При дії на розчин, що містить катіони Fe2+, розчинами лугів NaOH, KOH в осад випадає ферум(ІІ) гідроксид білого кольору:
Fe2+ + 2OH− → Fe(OH)2↓.
Fe2+ є досить сильним відновником. ЕºFe2+/Fe3+ = –0,77В, тому йон Fe2+ у розчині або  в осаді легко окиснюється навіть киснем повітря до Fe3+. Гідратований йон Fe2+ має зеленувате забарвлення. При окисненні утворюється йон Fe3+, який має коричнево-буре забарвлення . На повітрі білий осад Fe(OH)2 досить швидко набуває сіро-зеленого забарвлення, а потім бурого.
в осаді легко окиснюється навіть киснем повітря до Fe3+. Гідратований йон Fe2+ має зеленувате забарвлення. При окисненні утворюється йон Fe3+, який має коричнево-буре забарвлення . На повітрі білий осад Fe(OH)2 досить швидко набуває сіро-зеленого забарвлення, а потім бурого.
Дослід 2. При взаємодії катіонів Fe2+ з водним розчином амоніаку теж утворюється осад ферум(ІІ) гідроксиду:
2NH3·H2O + Fe2+ → Fe(OH)2↓ + 2NH4+.
Цю реакцію треба проводити у сильнолужному середовищі при рН=12-13. Наявність йонів амонію перешкоджає випадінню осаду оскільки вони зміщують рівновагу у бік утворення йонів Fe2+ у розчині.
Дослід 3. Калій гексаціано(ІІІ) ферат взаємодіє з катіонами Fe2+ з утворенням синього осаду турнбулевої сині – ферум(ІІ) гексаціано(ІІІ) ферату:
2[Fe(СN)6]3– + 3Fe2+ → Fe3[Fe(СN)6]2↓
Цей осад нерозчинний у кислотах. Доцільно цю реакцію проводити в сильнокислому середовищі при рН=3. При дії лугів NaOH або КОН на осад турнбулевої сині вона розкладається.
Катіони Fe3+ та інші катіони п’ятої аналітичної групи не заважають перебігу даної реакції.
Дослід 4. При взаємодії катіонів Fe2+ з диметилгліоксимом (реактив Чугаєва) утворюється хелатний комплекс карміново-червоного кольору, відмінного за забарвлення відповідного комплексу з Ніколом:
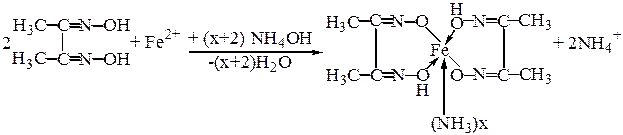
Дана реакція проводиться у амоніачному середовищі при рН≈9. Перебігу цієї реакції заважають катіони Mn2+, Ni2+, які утворюють з реактивом Чугаєва відповідні забарвлені комплекси, а катіони Со2+ при високих концентраціях утворюють осад бурого кольору.
Дослід 5. Катіони Fe2+ у кислих розчинах утворюють хелатні комплекси червоного кольору також з α,α'-дипіридилом:
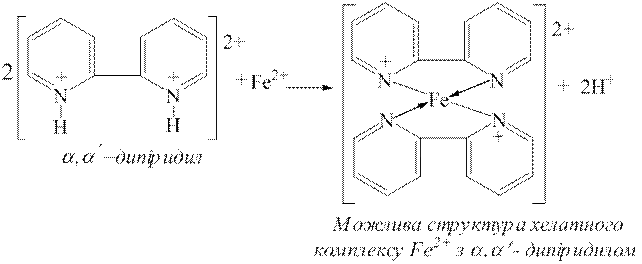 | |
Для проведення цієї реакції до декількох крапель досліджуваного на катіони Fe2+ розчину додають декілька крапель розчину хлоридної кислоти (с(  НCl)=0,1моль/дм3) і краплю розчину α,α'-дипіридил гідрохлориду. За наявності йонів Fe2+ виникає червоне забарвлення.
НCl)=0,1моль/дм3) і краплю розчину α,α'-дипіридил гідрохлориду. За наявності йонів Fe2+ виникає червоне забарвлення.
Перебігу цієї реакції йони Fe3+ не заважають.
Дослід 6. Окиснення катіона Fe2+ у Fe3+.
Для проведення цієї реакції беруть декілька крапель розчину, що містить йони Fe2+, додають 2-3 краплі розчину сульфатної кислоти (с(  Н2SO4)=2,0моль/дм3) та 2-3 краплі розчину нітратної кислоти (w=30%), суміш нагрівають. Реакцію проводять у витяжній шафі:
Н2SO4)=2,0моль/дм3) та 2-3 краплі розчину нітратної кислоти (w=30%), суміш нагрівають. Реакцію проводять у витяжній шафі:
3Fe2+ + 4Н+ + NO3− → 3Fe3+ + NO↑ + 2H2O.
Зеленувате забарвлення розчину змінюється на коричнево-буре.
Дослід 7. Виявлення Fe2+-іонів за реакцією з 1,10-фенантроліном.
Fe2+-іони утворюють з 1,10-фенантроліном при рН 2–9 інтенсивно забарвлену у червоно-оранжевий колір комплексну сполуку:
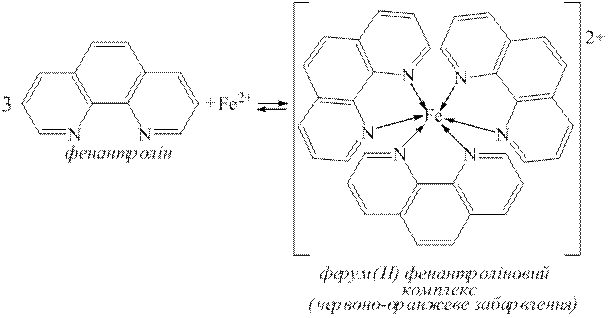
До декількох крапель розведеного водою досліджуваного на наявність Fe2+-іонів розчину з рН 3-4 додають декілька крапель водного розчину 1,10-фенантроліну (w=0,3%). З’являється червоно-оранжеве забарвлення. Комплексна сполука стійка протягом тривалого часу. Fe3+-іони не заважають виявленню Fe2+-іонів за цим методом. Цією реакцією можна виявити 0,05 мг/дм3 йонів Fe2+.
4.6.2. Реакції виявлення катіонів Fe3+
Гідратовані йони Fe3+ мають у розведених розчинах жовто-оранжеве забарвлення, а у концентрованих – червоно-буре.
Дослід 1. Катіони Fe3+ з розчинами лугів або амоніаку утворюють практично нерозчинний у воді ферум(ІІІ) гідроксид Fe(OH)3 червоно-бурого кольору.
ДР(Fe(OH)3)=3,2·10–40.
Ферум(ІІІ) гідроксид не має амфотерних властивостей і не розчиняється у надлишку лугу, а також не розчиняється у розчинах солей амонію.
У розчинах кислот Fe(OH)3 розчиняється добре:
Fe(OH)3 + 3НCl → FeCl3 + 3H2O;
Fe(OH)3 + 3Н+ → Fe3+ + 3H2O.
Дослід 2. Показовою реакцією на катіони Fe3+ є реакція з калій гексаціано(ІІ) фератом K4[Fe(CN)6]. При взаємодії йонів Fe3+ з цим реагентом утворюється темно-синій осад берлінської лазурі – ферум(ІІІ) гексаціано(ІІ) ферату Fe4[Fe(CN)6]3. Ця реакція краще проходить у слабкокислому середовищі.
Для проведення цієї реакції у пробірку вносять декілька крапель досліджуваного на наявність Fe3+-іонів розчину, додають декілька крапель дистильованої води, 1-2 краплі розчину хлоридної кислоти та 2 краплі розчину K4[Fe(CN)6]. Утворюється синій осад або синє забарвлення. Ця реакція дуже чутлива. Катіони Fe2+ та інші не заважають виявленню йонів Fe3+ за цією реакцією. Розчини лугів розкладають берлінську лазур. При додаванні надлишку K4[Fe(CN)6] може утворитися розчинна форма берлінської лазурі.
Дослід 3. Надзвичайно чутливою і специфічною реакцією на катіони Fe3+ є їх взаємодія з роданід-іонами SCN−:
Fe3+ + 3SCN− → [Fe(SCN)3] або [FeSCN]2+; [Fe(SCN)2]+; [Fe(SCN)6]3–.
При цьому утворюються різні форми ферум(ІІІ) роданідів криваво-червоного забарвлення. Реакцію доцільно проводити при рН<3 і застосовувати концентровані розчини реагентів NH4SCN чи KSCN. Катіони Fe2+ не заважають перебігу даної реакції.
Дослід 4. Сульфосаліцилова кислота з катіонами Fe3+ утворює розчинну внутрішньокомплексну сіль, яка має фіолетове забарвлення:
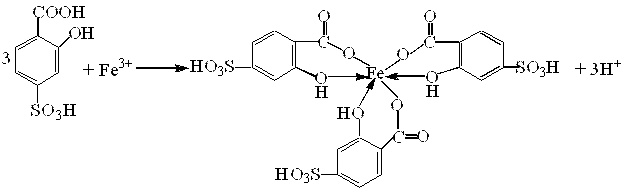 .
.
Жоден з катіонів всіх аналітичних груп не заважає виявленню йонів Fe3+ за цією реакцією. Аніони F−, РО43–, лимонної, винної кислот заважають перебігу цієї реакції, руйнують утворений комплекс включаючи Ферум або в осад, або в малодисоційовану сполуку, або в інший комплекс.
Реакція дуже чутлива, дозволяє виявляти близько 2,5мг/дм3 йонів Fe3+.
4.6.3. Реакції виявлення катіонів Mn2+
Гідратовані катіони Mn2+ мають блідо-рожеве забарвлення, а в розведених розчинах таке забарвлення не спостерігається.
Дослід 1. При взаємодії з лугами катіони Mn2+ утворюють малорозчинний Mn(OH)2 білого кольору. ДР(Mn(OH)2)=4·10–14. Манган гідроксид не має амфотерних властивостей і в надлишку розчину лугу не розчиняється, а в розчинах кислот розчиняється добре:
Mn(OH)2 + 2H+ → Mn2+ + 2H2O.
Хімічний елемент Манган у сполуках може мати різні ступені окиснення: 7+, 6+, 4+, 3+, 2+.
Катіон Mn2+ є досить сильним відновником, а тому легко окиснюється переходячи у більш високі ступені окиснення.
Різні форми Мангану забарвлені у різні кольори:
MnO4– та MnO42– мають фіолетове забарвлення; MnO2 – коричневе.
На повітрі білий осад Mn(OH)2 швидко змінює забарвлення на жовто-буре, а потім на коричневе за рахунок окиснення Мангану зі ступенем окиснення 2+ у Манган зі ступенем окиснення Мангану 4+ у формі MnO(OH)2↓ або H2MnO3.
Реакція Mn2+ + 2OH− → Mn(OH)2 проводиться при рН=9-10.
Дослід 2. При додаванні до розчину, що містить йони Mn2+, розчину амоніаку теж випадає білий осад Mn(OH)2. У присутності солі амонію осадження не відбувається. Mn(OH)2 на відміну від MnO(OH)2 розчиняється у розведеній сульфатній кислоті, а також в надлишку розчину амоніаку особливо за наявності солей амонію.
Реакція проводиться при рН=9-10.
Mn2+ + 2NH3·H2O → Mn(OH)2 + 2NH4+.
У присутності солей амонію відбувається пригнічення дисоціації NH3·H2O  NH4++ОН− внаслідок чого концентрація ОН−-іонів настільки знижується, що фактичний добуток рівноважних концентрацій йонів ОН− та Mn2+ не може перевищити ДР(Mn(OH)2). З часом з амоніачного розчину , що містить катіони Mn2+ та NH4+, внаслідок окиснення Mn2+ випадає осад H2MnO3.
NH4++ОН− внаслідок чого концентрація ОН−-іонів настільки знижується, що фактичний добуток рівноважних концентрацій йонів ОН− та Mn2+ не може перевищити ДР(Mn(OH)2). З часом з амоніачного розчину , що містить катіони Mn2+ та NH4+, внаслідок окиснення Mn2+ випадає осад H2MnO3.
Дослід 3. Специфічною реакцією на катіони Mn2+, що дозволяє виявити цей катіон у присутності катіонів всіх аналітичних груп, є реакція окиснення Mn2+ в аніон MnO4−.
Як окисник у цій реакції можна застосувати плюмбум диоксид PbO2, амоній персульфат (NH4)2S2O8 та інші окисники зі значеннями величин окисно-відновних потенціалів більше +1,52В, оскільки
ЕºMnO4–/Mn2+ = +1,52В.
ЕºPbO2/Pb2+ = +1,68В; ЕºS2O82−/2SO42– = +2,01В.
Для проведення реакції окиснення Mn2+ за участі PbO2 у пробірку вносять невелику кількість порошку PbO2, додають декілька крапель розчину нітратної кислоти, нагрівають. Якщо розчин після цього не набуде забарвлення, то тоді до нього додають краплю розведеного приблизно в десять разів досліджуваного на катіони Mn2+ розчину та розмішують його. За наявності у розчині катіонів Mn2+ з’являється рожеве забарвлення за рахунок MnO4−:
Mn2+ + 3PbO2 + 4H+ → MnO4− + 3Pb2+ + 2H2O.
Ця реакція повинна проводитись при рН<2. Для дослідження не можна брати сіль MnCl2, оскільки за даних умов будуть окиснюватись йони Cl− до вільного хлору:
2Cl− + PbO2 + 4H+ → Cl2 + Pb2+ + 2H2O.
Аніони-відновники, якщо вони є в досліджуваному розчині, будуть заважати окисненню Mn2+ у MnO4−, тому їх попередньо слід видалити з розчину. Реакцію краще проводити при помірному нагріванні.
У іншій реакції окиснення Mn2+ до MnO4− можна застосувати окисник амоній персульфат у присутності як каталізатора AgNO3:
2Mn2+ + 5S2O82– + 8H2O → 2MnO4− + 10SO42– + 16H+.
Для проведення цієї реакції у пробірку вносять трохи кристалічного амоній персульфату, додають близько 10 крапель розчину нітратної кислоти (с(  HNO3)=2,0моль/дм3), 2 краплі розчину AgNO3 та нагрівають. У нагріту суміш занурюють скляну паличку, змочену досліджуваним на катіони Mn2+ розчином та перемішують. Якщо забарвлення, що виникло, слабке, то можна ще додати досліджуваного розчину. Якщо ж , навпаки, випадає бурий осад MnO(OH)2, то концентрація катіонів Mn2+ була великою. Катіон Mn2+ при цьому окиснюється до MnO4− рожевого забарвлення у вигляді манганової кислоти HMnO4.
HNO3)=2,0моль/дм3), 2 краплі розчину AgNO3 та нагрівають. У нагріту суміш занурюють скляну паличку, змочену досліджуваним на катіони Mn2+ розчином та перемішують. Якщо забарвлення, що виникло, слабке, то можна ще додати досліджуваного розчину. Якщо ж , навпаки, випадає бурий осад MnO(OH)2, то концентрація катіонів Mn2+ була великою. Катіон Mn2+ при цьому окиснюється до MnO4− рожевого забарвлення у вигляді манганової кислоти HMnO4.
Цю реакцію слід проводити у сильнокислому середовищі при рН<2. Концентрація йонів Mn2+ у досліджуваному розчині повинна бути мінімальною. Відновники Cl−, Br−, I− та інші заважають перебігу цієї реакції.
Дослід 4. Менш характерною реакцією виявлення катіонів Mn2+ є їх окиснення до MnO2 у лужному середовищі.
До окремої проби досліджуваного розчину додають розчин лугу. При цьому всі катіони п’ятої аналітичної групи випадають в осад у вигляді гідроксидів, які мають білий колір − (Bi(OH)3, Mg(OH)2, Sb(OH)3) або ж буре забарвлення − (Fe(OH)3). Якщо до отриманого осаду гідроксидів додати декілька крапель розчинів H2O2, KClO3, бромної або хлорної води і нагріти до кипіння, то за наявності Mn(OH)2 осад набуде майже чорного забарвлення внаслідок окиснення Mn(OH)2 до MnO2. Виявленню катіонів Mn2+ за цією реакцією серед катіонів п’ятої аналітичної групи заважають тільки катіони Fe2+ та Fe3+. З катіонів інших аналітичних груп заважають такому виявленню йонів Mn2+ катіони Cu2+, Co2+, Ni2+, Hg2+, Hg22+, Ag+, які утворюють у лужному середовищі чорні або кольорові осади.
Дослід 5. Йони гексаціано(ІІ) ферату [Fe(CN)6]4– з катіонами Mn2+ утворюють білий малорозчинний у розведених кислотах осад манган гексаціано(ІІ) ферату:
2Mn2+ + [Fe(CN)6]4– → Mn2[Fe(CN)6]↓.
Цей осад під дією лугу розкладається з утворенням Mn(OH)2:
Mn2[Fe(CN)6]↓ + 4ОН− → 2Mn(OH)2 + [Fe(CN)6]4–.
Утворений Mn(OH)2 окиснюється киснем повітря до кислоти H2MnO3.
Дослід 6. Катіони Mn2+ можна виявити механохімічним способом.
У заглиблення порцелянової пластинки вміщують крупинку солі Мангану, додають 1-2 кристали AgNO3 і суміш розтирають маленьким товкачиком. Потім додають краплю розведеного розчину амоніаку. Відбувається миттєве почорніння реакційної суміші внаслідок відновлення йонів Ag+ до металічного срібла і окиснення йонів Mn2+ до H2MnO3:
Mn2+ + 2Ag+ + 4NH4OH → 2Ag↓ + H2MnO3↓ + 4NH4+ + H2O
Mn(OH)2 також реагує з AgNO3:
Mn(OH)2↓ + 2AgNO3 +2NH4OH → H2MnO3 + 2Ag↓ + 2NH4NO3 + H2O.
Дослід 7. При взаємодії йонів Mn2+ з йонами [Fe(CN)6]3– утворюється бурий осад:
3Mn2+ + 2[Fe(CN)6]3– → Mn3[Fe(CN)6]2↓.
Дослід 8. З карбонат-іонами йони Mn2+ утворюють білий осад манган карбонату:
Mn2+ + CO32− → MnCO3.
4.6.4. Реакції виявлення катіонів Bi3+
Дослід 1. Солі Бісмуту сильно гідролізуються за катіоном Bi3+ з утворенням малорозчинних основних солей:
BiCl3 + 2H2O  Bi(OH)2Cl↓ + 2HCl.
Bi(OH)2Cl↓ + 2HCl.
Утворений бісмут дигідроксохлорид Bi(OH)2Cl не стійкий, втрачає молекулу води, перетворюючись на бісмутил хлорид:
Bi(OH)2Cl → BiOCl↓ + Н2О.
Внаслідок таких властивостей солей Бісмуту у розчинах завжди є білий осад бісмутилів. З них BiOCl менш розчинний, ніж BiONO3.
Перед дослідженням розчинів на вміст катіонів Ві3+ до білої суспензії бісмутитів слід додати концентровані розчини хлоридної чи нітратної кислоти до повного розчинення осаду:
BiOCl + 3HNO3 → Bi(NO3)3 + HCl + H2O;
BiOCl + 2H+ → Bi3+ + Cl− + H2O;
Солі Стибію заважають проведенню реакцій гідролізу солей Бісмуту, оскільки теж утворюють малорозчинні стибіли (наприклад SbOCl). Проте, стибіл хлорид SbOCl розчинний у винній кислоті, а BiOCl – нерозчинний.
Дослід 2. При дії на розчин, що містить катіони Bi3+, розчинами лугів NaOH або KOH утворюється білий осад бісмут гідроксиду:
Bi3+ + 3OH− → Bi(OH)3↓,
який розчинний у кислотах, але нерозчинний у розчинах лугів, оскільки Bi(OH)3 амфотерних властивостей не має. При нагріванні Bi(OH)3 переходить у нерозчинний бісмутил гідроксид BiOOH.
Дослід 3. Як катіони Sn2+ можна виявити у лужному середовищі за участі катіонів Bi3+, так і, навпаки, йони Bi3+ можна виявити шляхом їх відновлення до металічного бісмуту йонами SnO22–:
Sn2+ + 2OH− → Sn(OH)2↓;
Sn(OH)2 + 2OH− → SnO22– + 2H2O;
Bi3+ + 3OH− → Bi(OH)3↓;
2Bi(OH)3 + 3SnO22– → 3SnO32– + 2Bi↓ + 3H2O.
Випадає чорний осад металічного бісмуту.
При проведенні цієї реакції застосовується свіжоприготовлений розчин SnCl2 у хлоридній кислоті з гранулами металічного Sn на дні посудини. Не слід брати великого надлишку лугу. Проведенню цієї реакції заважають катіони, які у лужному середовищі утворюють нерозчинні сполуки або створюють якесь інше забарвлення, особливо сіре або чорне (Ag2O, Hg2O, Fe(OH)3).
Дослід 4. Катіони Bi3+ можна виявити мікрокристалоскопічною реакцією утворення кристалів комплексних сполук Бісмуту.
Для проведення цієї реакції до краплини кислого розчину, що містить катіони Bi3+, додають крупинку кристалічного KI та RbCl або СsCl. Утворюються червоні шестикутні кристали комплексної солі рубідій пентаіодо(ІІІ) бісмутату Rb2[BiI5]·2,5Н2О або цезій пентаіодо(ІІІ) бісмутату Cs2[BiI5]·2,5Н2О, які розглядають під мікроскопом.
Рис. … Кристали цезій пентаіодо(III) бісмутату
Аналогічні кристали утворюють катіони Sb3+. Значні кількості катіонів Sn2+ та Pb2+ заважають виявленню катіонів Bi3+ за цією реакцією.
Дослід 5. Катіони Bi3+ можна також відновити металічними алюмінієм, цинком, залізом. Для цього беруть пластинки з цих металів, очищають поверхню від бруду та оксидів і на очищене місце наносять декілька крапель підкисненого хлоридною кислотою досліджуваного розчину. За наявності у розчині катіонів Bi3+ через декілька хвилин під краплями з’являються чорні плями відновленого бісмуту:
3Fe + 2Bi3+ → 2Bi↓ + 3Fe2+.
Цій реакції заважають тільки катіони Sb3+ та Hg2+.
Дослід 6. При дії на розчини, що містять катіони Bi3+, невеликої кількості розчину КІ утворюється чорний осад BiI3:
Bi3+ + 3I− → BiI3↓.
При виявленні катіонів Bi3+ за цією реакцією слід уникати надлишку КІ.
При надлишку КІ розчин набуває червонувато-жовтого забарвлення внаслідок утворення комплексної солі К[BiI4]:
Bi3+ + 3КІ → BiI3↓ + 3К+;
BiI3↓+ KI → К[BiI4].
З катіонів п’ятої аналітичної групи виявленню катіонів Bi3+ калій йодидом заважають Sb5+ та Fe3+, оскільки вони окиснюють йодид-іони до І2, внаслідок чого розчин буде забарвлюватись у червоно-коричневий колір. Проте, катіони Fe3+ з розчину можна видалити відновивши їх до Fe2+ щавлевою кислотою, а катіони Sb5+ – шляхом гідролізу їх з розчину нітратної кислоти. З катіонів інших аналітичних груп виявленню катіонів Bi3+ за цією реакцією заважають катіони Ag+, Pb2+, Cu2+, Hg2+.
Дослід 7. Реакцію на катіони Bi3+ з калій йодидом доцільно проводити крапельним методом у присутності цинхоніну, оскільки при цьому утворюється оранжевий осад комплексної солі BiI3[C19H22ON2]·HI, яка у надлишку розчину КІ нерозчинна.
Для виявлення катіонів Bi3+ за цією реакцією на фільтрувальний папір наносять краплю досліджуваного розчину, підкисненого хлоридною кислотою, і на неї – краплю реактиву. При цьому за наявності у розчині катіонів Bi3+ на папері утворюється оранжева пляма. Для приготування реактиву цинхоніну у 100г гарячої води розчиняють 1г цинхоніну, додають 5-10 крапель концентрованої нітратної кислоти. Після охолодження до цього розчину додають 2г КІ.
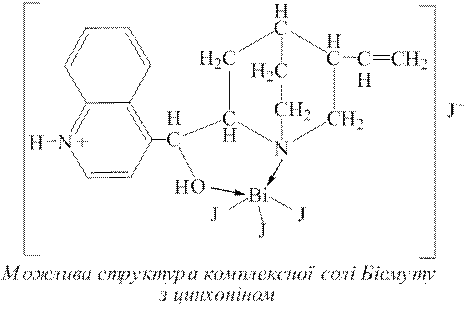
Інші катіони п’ятої аналітичної групи не заважають виявленню катіонів Bi3+ за цією реакцією. З катіонів інших аналітичних груп заважають виявленню за цією реакцією тільки катіони Hg22+, які з цим реактивом утворюють сполуку, що має буре забарвлення. При порівняно високих концентраціях з цим реактивом йони Ag+, Hg2+, Pb2+, Sb3+ утворюють жовті плями. При високих концентраціях йони Co2+, Ni2+, Cr3+ заважають проведенню цієї реакції власним забарвленням.
Дослід 7. Для виявлення катіонів Bi3+ за реакцією з тіосечовиною або роданід-іонами у заглиблення порцелянової пластинки вносять краплю досліджуваного розчину, підкисненого хлоридною кислотою, і сюди ж вносять кристалик тіосечовини або калій роданіду чи амоній роданіду. За наявності у розчині катіонів Bi3+ пляма набуває характерного жовтого або червоно-бурого забарвлення відповідно – утворення комплексного йона [Bi(SCN)4]–
| або, відповідно, |  | . Цій реакції виявлення |
катіонів Bi3+ pа участі йонів SCN– заважають катіони Fe3+, які з йонами SCN− утворюють комплекси , що мають криваво-червоне забарвлення; катіони Cu2+, які утворюють з йонами SCN− сполуки рожевого забарвлення, а при висиханні – синє забарвлення. За наявності катіонів Hg2+ утворюється чорний осад . З тіосечовиною цій реакції заважають катіони Sb3+, Sb5+, які дають той же ефект , що і катіони Bi3+, а катіони Cu2+, Co2+, Ni2+, Cr3+ маскують своїм забарвленням колір комплексного йона Бісмуту.
Дослід 8. При взаємодії катіонів Bi3+ з H2S або Na2S2O3 у розчині хлоридної кислоти утворюється чорний осад Bi2S3:
2 Bi3+ + 3H2S → Bi2S3↓ + 6Н+;
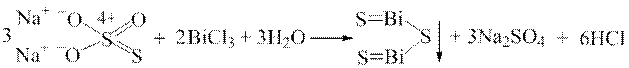
4.6.5. Реакції виявлення катіонів Mg2+
Дослід 1. При додаванні до розчину, що містить катіони Mg2+, розчину лугів NaOH, KOH утворюється білий аморфний осад магній гідроксиду, який розчиняється у розчинах кислот і солей амонію:
Mg2+ + 2OH− → Mg(OH)2↓;
Mg(OH)2 + 2H+ → Mg2+ + 2H2O.
Mg2+ + 2NH4OH → Mg(OH)2↓ + 2NH4+;
Mg(OH)2 + 2NH4+ → Mg2+ + 2NH4OH.
з солі
амонію
Дослід 2. Натрій гідрофосфат Na2HPO4 з катіонами Mg2+ у присутності амоній хлориду та амоній гідроксиду утворює білий кристалічний осад магній-амоній фосфату:
Mg2+ + HPO42– + NH4OH → MgNH4PO4 + H2O.
Амоній хлорид додають для того, щоб не випав осад Mg(OH)2.
Для проведення цієї реакції у пробірку вносять 3-4 краплі розчину солі магнію, додають 4-6 крапель розчину хлоридної кислоти (с(  HCl)=2,0моль/дм3) та краплинами розчин Na2HPO4. Після цього додають до розчину по одній краплині розчину амоніаку (с=2,0моль/дм3), перемішуючи розчин після кожної краплі. Спочатку розчин амоніаку нейтралізує хлоридну кислоту:
HCl)=2,0моль/дм3) та краплинами розчин Na2HPO4. Після цього додають до розчину по одній краплині розчину амоніаку (с=2,0моль/дм3), перемішуючи розчин після кожної краплі. Спочатку розчин амоніаку нейтралізує хлоридну кислоту:
HCl + NH4OH → NH4Cl + H2O.
Амоній хлорид перешкоджає утворенню при цьому осаду Mg(OH)2. Випадає характерний кристалічний осад MgNH4PO4.
Дану реакцію слід проводити в амоніачному середовищі при рН=8. Надлишок йонів NH4+ заважає випадінню осаду MgNH4PO4. Більшість катіонів, за винятком Na+, K+, заважають проведенню цієї реакції.
Дослід 3. Катіони Mg2+ можна виявити також мікрокристалоскопічною реакцією .
Краплю розчину, що містить йони Mg2+, наносять на предметне скло мікроскопа, додають краплю розчину амоніаку (w=25%), потім у краплю вносять кристалик Na2HPO4 і розглядають утворені кристали MgNH4PO4 під мікроскопом.
Рис. … Кристали магній-амоній фосфату
Дослід 4. Азобарвники – n-нітрофенілазорезорцин

та n-нітрофенілазо-α-нафтол
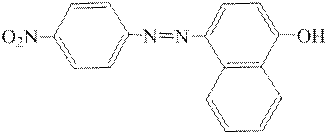
у лужному середовищі мають червоний або червоно-фіолетовий колір. Арсорбуючись на поверхні Mg(OH)2, вони забарвлюють білий осад Mg(OH)2.
Для проведення цієї реакції на порцелянову пластинку наносять 1-2 краплі розчину, що містить йони Mg2+, та додають 1-2 краплі лужного розчину реактиву. З’являється синє забарвлення або синій осад. Якщо розчин має рН<10, то може з’явитись жовте забарвлення.
Ця реакція заснована на властивості Mg(OH)2 адсорбувати деякі барвники.
Солі амонію заважають перебігу цієї реакції.
Дослід 5. Катіони Mg2+ з оксихіноліном утворюють кристалічний осад магній оксихінолінату, який має зеленувато-жовте забарвлення:
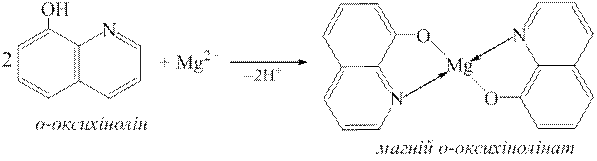
Для осадження магній оксихінолінату необхідне слабколужне середовище. Для цього до розчину додається водний розчин амоніаку.
До декількох крапель досліджуваного на Mg2+-іони розчину додають стільки ж розчину амоніаку, потім розчин NH4Cl до повного розчинення осаду Mg(OH)2 та декілька крапель розчину оксихіноліну. З розчину випадає кристалічний зеленувато-жовтий осад Mg(C9H6NO)2.
Дослід 6. При взаємодії катіонів Mg2+ з Na2CO3 або К2CO3 випадає білий осад основної солі:
2Mg2+ +2CO32– + Н2О→ Mg2(OH)2CO3↓ + CO2↑.
Утворений осад легко розчиняється як в кислотах, так і в солях амонію, тому амоній карбонат не дає повного осадження через зміщення рівноваги реакції у міру накопичення йонів NH4+ ліворуч:
2MgCl2 + 2(NH4)2CO3 + H2O  (MgOH)2CO3↓ + 4NH4Cl + CO2↑.
(MgOH)2CO3↓ + 4NH4Cl + CO2↑.
Якщо попередньо до розчину солі Магнію додати сіль амонію, то основного магній карбонату не випадає при додаванні розчину (NH4)2CO3.
4.6.6. Реакції виявлення катіонів Sb3+
Дослід 1. Як вже зазначалось, солі Sb3+ гідролізуються в більшій мірі, ніж солі Bi3+:
SbCl3 + H2O  SbOCl↓ + 2HCl,
SbOCl↓ + 2HCl,
тому водні розчини солей Стибію являють собою суспензію стибілів або антимонілів.
Для проведення цієї реакції гідролізу декілька крапель розчину SbCl3 розводять водою. Випадає білий осад стибіл хлориду. Значення рН середовища при цьому повинно бути не менше 3-4. При нижчому значенні рН осад може не утворитись. Реакцію доцільно проводити при нагріванні. За наявності у розчині винної кислоти осад не утворюється.
З катіонів п’ятої аналітичної групи гідролізу Sb3+ заважають тільки катіони Bi3+, які теж гідролізуються з утворенням осадів бісмутил хлориду BiOCl або бісмутил нітрату BiONO3. Але якщо гідроліз йонів проводити у присутності нітратної кислоти, то йони Bi3+ при цьому не гідролізуються, а йони Sb3+ гідролізуються. Для цього до розчину, що містить катіони Sb3+ та Bi3+, додають спочатку такий же об’єм розчину HNO3, а потім 2-3-кратний об’єм води. При цьому вже на холоді випадає осад SbOCl. При нагріванні з надлишком хлоридної кислоти осад SbOCl розчиняється.
Дослід 2. Катіони Sb3+ з тіосульфат-іонами при нагріванні утворюють осад Sb2OS2 червоного кольору:
2Sb3+ + 2S2O32– + 3Н2О → Sb2OS2↓ + 2SO42– + 6H+.
За наявності у розчині йонів Bi3+ випадає чорний осад Bi2S3, що маскує червоне забарвлення Sb2OS2.
Для проведення цієї реакції у пробірку вносять 2-3 краплі розчину SbCl3, додають краплю сульфатної кислоти та 5-6 крапель води, вносять кристалик Na2S2O3 і нагрівають. Випадає червоний осад Sb2OS2. Слід мати на увазі, що надлишок сульфатної кислоти розкладає натрій тіосульфат:
Na2S2O3 +Н2SO4 → Na2SO4 + SO2↑+ S↓ + H2O.
Перебігу даної реакції заважають катіони Cu2+, Hg2+ та ін., які утворюють малорозчинні сульфіди.
Дослід 3. Можливою, але не дуже показовою реакцією виявлення катіонів Sb3+ може бути реакція відновлення Sb3+ до металічного стибію металами, які електрохімічно більш активні, ніж Стибій.
Наприклад: 3Zn + 2SbCl3 → 2Sb↓ + 3ZnCl2.
На добре очищену металеву пластинку (цинкову, алюмінієву, залізну та ін.) наносять краплю підкисненого хлоридною кислотою досліджуваного розчину. Через деякий час поверхня пластини під краплею стає чорною від металічного стибію.
Цю реакцію необхідно проводити у сильнокислому середовищі при рН=1-2.
Досліджуваний розчин не повинен містити сильних окисників.
Дослід 4. При дії на розчин солей Sb3+ розчинами лугів випадає білий осад стибій(ІІІ) гідроксиду:
Sb3+ + 3ОН− → 2Sb(ОН)3↓.
Осад Sb(ОН)3 має амфотерні властивості і тому розчиняється як в надлишку кислоти:
Sb(ОН)3 + 3Н+ → Sb3+ + 3Н2О.
так і в надлишку розчину лугу; при цьому утворюються солі метастибійнистої кислоти:
Н3SbО3↓ → НSbО2↓ + Н2О.
ортостибійниста метастибійниста
кислота кислота
НSbО2↓ + NaOH → NaSbO2 + H2O.
Дослід 5. Розчин амоніаку осаджує катіони Sb3+ у вигляді метастибійної кислоти, практично нерозчинній у надлишку розчину амоніаку:
Sb3+ + 3NH3·H2О → Н3SbО3↓+ 3NH4+;
Н3SbО3↓ → НSbО2↓ + Н2О.
Дослід 6. При дії Н2S на підкиснені хлоридною кислотою розчини солей Sb3+ утворюється яскраво оранжевий осад стибій(ІІІ) сульфіду:
2SbCl3 + 3Н2S → Sb2S3↓ + 6HCl.
Осад Sb2S3 розчиняється при нагріванні в розчині хлоридної кислоти (1:1):
Sb2S3 + 12HCl → 2H3[SbCl6] + 3H2S↑.
Дією нітратної кислоти на Sb2S3 утворюється білий малорозчинний осад метастибійної кислоти:
3Sb2S3 + 10HNO3 → 6HSbO3↓ + 9S↓ + 10NO↑ + 2H2O.
Стибій(ІІІ) сульфід, під дією розчину Na2S або розчину лугу розчиняється з утворенням тіосолі або суміші тіосолі та солі відповідної оксигеновмісної кислоти:
Sb2S3 + 3Na2S → 2Na3SbS3;
Sb2S3 + 6NaOH → Na3SbS3 + Na3SbО3 + 3H2O.
На відміну від As2S3, As2S5, стибій(ІІІ) сульфід не розчиняється повністю під дією (NH4)2CO3 або NH4OH, але деяка його частина переходить у розчин при дії цих реагентів у вигляді відповідних тіосолей. Тіосолі Sb3+ легко розкладаються кислотами з утворенням вільних тіокислот, які дуже нестійкі і розкладаються з утворенням Sb2S3 та H2S.
Дослід 7. При дії металічного цинку на достатньо кислі розчини солей Sb3+ відбувається відновлення Sb3+ до металічного стибію, а також виділяється SbH3 – газ без кольору та запаху:
Zn + 2Sb3+ + 3H+ → Zn2+ + Sb↓ + SbH3.
У сполуці SbH3 ступінь окиснення Стибію дорівнює 3–. SbH3 – сильний відновник і легко відновлює йони важких металів, наприклад Ag+, до металічного стану.
4.6.7. Реакції виявлення Стибію зі ступенем окиснення 5+
Стибій зі ступенем окиснення 5+ входить до складу комплексного аніона [SbCl6]– при взаємодії HSbO3 з HCl:
HSbO3 + 6HCl → Н[SbCl6] + 3Н2О.
Дослід 1. У лужному середовищі за участі NaOH, KOH або NH3·H2O комплексний аніон [SbCl6]– перетворюється на білий осад метастибійної кислоти HSbO3:
[SbCl6]− + 5ОН− → HSbO3↓ + 6Сl− + 2Н2О.
Дослід 2. Солі SbV гідролізуються з утворенням білого осаду основної солі:
[SbCl6]− + 2Н2О → SbO2Сl↓ + 5Cl– + 4Н+.
Якщо реакційну суміш підігріти, то реакція йде до утворення ортостибійної кислоти H3SbO4 або SbO(ОH)3:
SbO2Cl + 2Н2О → H3SbO4↓ + НCl.
Осад H3SbO4 розчиняється при дії розчинів кислоти або лугу:
SbO(ОH)3 + 5HCl → SbCl5 + 4H2O;
H3SbO4 + 3NaOH → Na3SbO4 + 3H2O.
Одержана в результаті цієї реакції сіль ортостибійної кислоти легко гідролізується, утворюючи нормальну або кислу солі піростибійної кислоти:
2К3SbO4 + H2O → 2KOH + K4Sb2O7;
K4Sb2O7 + 2H2O → 2KOH + K2Н2Sb2O7.
Дослід 3. При дії розчину амоніаку на солі Sb5+ утворюється білий аморфний осад метастибійної кислоти.
Дослід 4. При взаємодії солей Me3SbO4 з гідроген сульфідом у помірно кислих розчинах утворюється оранжево-червоний осад Sb2S5. Стибій(V) сульфід розчиняється при взаємодії з Na2S з утворенням тіосолі метастибійної кислоти:
Sb2S5 + 3Na2S → 2Na3SbS4,
а при взаємодії з розчином лугу – суміші тіосолі з тіокислотою:
Sb2S5 + 6NaОН → Na3SbS4 + Na3SbО3S + 3Н2О.
Тіосолі SbV легко руйнуються кислотами з утворенням Sb2S5. Стибій(V) сульфід легко розчиняється в концентрованій хлоридній кислоті при нагріванні. У цій реакції окисником виступає Sb5+, а відновником – S2–. Отже, ця реакція є реакцію самоокиснення-самовідновлення:
Sb2S5 + 12HCl → 2H3[SbCl6] + 3H2S + 2S↓.
Дослід 5. Металічні Zn, Al, Sn і інші у кислому середовищі відновлюють Sb5+ до металічного стибію, який випадає з розчину у вигляді чорної маси:
2SbCl5 + 5Zn → 2Sb↓ + 5ZnCl2.
Дослід 6. Як і катіони Sb3+, катіони Sb5+ можуть бути відновлені у кислому середовищі до SbH3:
Sb5+ + Zn + 3H+ → 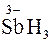 + Zn2+.
+ Zn2+.
Дослід 7. На відміну від йонів Sb3+, йони Sb5+ окиснюють йодид-іони у кислому середовищі до елементарного йоду, а Sb5+ при цьому відновлюється до Sb3+:
Sb5+ + 2І− → Sb3+ + І2.
Розчин забарвлюється в бурий колір йодом, який виділився. Цей йод можна екстрагувати в органічну фазу, яка при цьому набуде характерного фіолетового забарвлення.
Дослід 8. Люмінесцентне виявлення Стибію.
Стибій незалежно від ступеня його окиснення в сполуках можна виявити за характером забарвлення перлин СаО. Якщо на перлину з розжареного кальцій оксиду нанести краплю розчину, що містить солі Стибію, та знову прожарити у полум’ї газового пальника, то після охолодження перлини при її освітленні ультрафіолетовим світлом спостерігається інтенсивна люмінесценція від зеленувато-жовтого до блідожовтого кольору у залежності від вмісту Стибію у досліджуваному зразку. Ця реакція має дуже велику чутливість, що дає можливість виявити дуже незначні кількості Стибію у пробі.
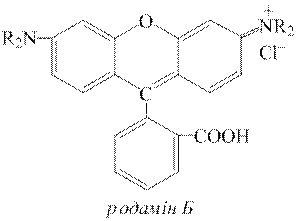
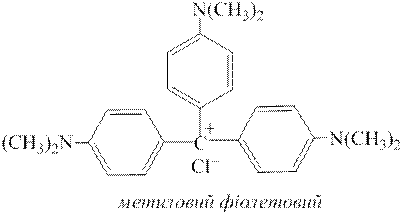
Дослід 9. Органічні барвники родамін Б та метиловий фіолетовий з катіонами Sb5+ дають фіолетово-синє забарвлення. Цю реакцію доцільно проводити крапельним методом.
Для цього до невеликої проби досліджуваного розчину додають 2-кратний об’єм розчину концентрованої хлоридної кислоти, потім декілька крапель розчину KNO3 або NaNO3 (с(  )=1,0моль/дм3) для окиснення Sb3+ у Sb5+. Через 1-2 хвилини кип’ятінням або додаванням до розчину сечовини CO(NH2)2 видаляють з нього надлишок йонів NO2−. Потім краплю цього розчину поміщають у заглиблення порцелянової пластинки та додають до неї одну краплю розчину родаміну Б або метилового фіолетового. За наявності у розчині катіонів Sb5+ пляма в обох випадках набуває фіолетового забарвлення. Жоден з катіонів не заважає виявленню SbV за цією реакцією.
)=1,0моль/дм3) для окиснення Sb3+ у Sb5+. Через 1-2 хвилини кип’ятінням або додаванням до розчину сечовини CO(NH2)2 видаляють з нього надлишок йонів NO2−. Потім краплю цього розчину поміщають у заглиблення порцелянової пластинки та додають до неї одну краплю розчину родаміну Б або метилового фіолетового. За наявності у розчині катіонів Sb5+ пляма в обох випадках набуває фіолетового забарвлення. Жоден з катіонів не заважає виявленню SbV за цією реакцією.
  |
